
La adsorción es la adhesión [1] de átomos , iones o moléculas de un gas, líquido o sólido disuelto a una superficie . [2] Este proceso crea una película del adsorbato en la superficie del adsorbente . Este proceso difiere de la absorción , en la que un fluido (el absorbato ) se disuelve o permea un líquido o sólido (el absorbente ). [3] Si bien la adsorción a menudo precede a la absorción, que implica la transferencia del absorbato al volumen del material absorbente, alternativamente, la adsorción es claramente un fenómeno de superficie, en el que el adsorbato no penetra a través de la superficie del material y en la masa del adsorbente. [4] El término sorción abarca tanto la adsorción como la absorción, y la desorción es lo inverso de la sorción.
adsorción : aumento de la concentración de una sustancia disuelta en la interfase de una fase condensada y una fase líquida debido a la acción de fuerzas superficiales. La adsorción también puede ocurrir en la interfase de una fase condensada y una fase gaseosa. [5]
Al igual que la tensión superficial , la adsorción es una consecuencia de la energía superficial . En un material a granel, todos los requisitos de enlace (ya sean iónicos , covalentes o metálicos ) de los átomos constituyentes del material son satisfechos por otros átomos en el material. Sin embargo, los átomos en la superficie del adsorbente no están completamente rodeados por otros átomos adsorbentes y, por lo tanto, pueden atraer adsorbatos. La naturaleza exacta del enlace depende de los detalles de las especies involucradas, pero el proceso de adsorción generalmente se clasifica como fisisorción (característica de las fuerzas de van der Waals débiles ) o quimisorción (característica del enlace covalente). También puede ocurrir debido a la atracción electrostática. [6] [7] La naturaleza de la adsorción puede afectar la estructura de las especies adsorbidas. Por ejemplo, la fisisorción de polímeros a partir de una solución puede dar como resultado estructuras aplastadas en una superficie. [8]
La adsorción está presente en muchos sistemas naturales, físicos, biológicos y químicos y se usa ampliamente en aplicaciones industriales como catalizadores heterogéneos , [9] [10] carbón activado , captura y uso de calor residual para proporcionar agua fría para aire acondicionado y otros requisitos de proceso (enfriadores de adsorción), resinas sintéticas , aumento de la capacidad de almacenamiento de carbones derivados de carburo y purificación de agua . [11] La adsorción, el intercambio iónico y la cromatografía son procesos de sorción en los que ciertos adsorbatos se transfieren selectivamente de la fase fluida a la superficie de partículas rígidas insolubles suspendidas en un recipiente o empaquetadas en una columna. Las aplicaciones de la industria farmacéutica, que utilizan la adsorción como un medio para prolongar la exposición neurológica a medicamentos específicos o partes de los mismos, [ cita requerida ] son menos conocidas.
La palabra "adsorción" fue acuñada en 1881 por el físico alemán Heinrich Kayser (1853-1940). [12]
La adsorción de gases y solutos se describe habitualmente mediante isotermas, es decir, la cantidad de adsorbato en el adsorbente en función de su presión (si es gas) o concentración (para solutos en fase líquida) a temperatura constante. La cantidad adsorbida casi siempre se normaliza por la masa del adsorbente para permitir la comparación de diferentes materiales. Hasta la fecha, se han desarrollado 15 modelos de isotermas diferentes. [13]
El primer ajuste matemático de una isoterma fue publicado por Freundlich y Kuster (1906) y es una fórmula puramente empírica para adsorbatos gaseosos:
donde es la masa de adsorbato adsorbido, es la masa del adsorbente, es la presión del adsorbato (esto se puede cambiar a concentración si se investiga la solución en lugar del gas), y y son constantes empíricas para cada par adsorbente-adsorbato a una temperatura dada. La función no es adecuada a presiones muy altas porque en realidad tiene un máximo asintótico a medida que la presión aumenta sin límite. A medida que aumenta la temperatura, las constantes y cambian para reflejar la observación empírica de que la cantidad adsorbida aumenta más lentamente y se requieren presiones más altas para saturar la superficie.
Irving Langmuir fue el primero en derivar una isoterma de adsorción con base científica en 1918. [14] El modelo se aplica a los gases adsorbidos en superficies sólidas. Es una isoterma semiempírica con una base cinética y se derivó con base en la termodinámica estadística. Es la ecuación de isoterma más común que se utiliza debido a su simplicidad y su capacidad para ajustarse a una variedad de datos de adsorción. Se basa en cuatro supuestos:
Estas cuatro suposiciones rara vez son todas ciertas: siempre hay imperfecciones en la superficie, las moléculas adsorbidas no son necesariamente inertes y el mecanismo claramente no es el mismo para las primeras moléculas que se adsorben a una superficie que para las últimas. La cuarta condición es la más problemática, ya que con frecuencia se adsorberán más moléculas a la monocapa; este problema se aborda mediante la isoterma BET para superficies relativamente planas (no microporosas ). No obstante, la isoterma de Langmuir es la primera opción para la mayoría de los modelos de adsorción y tiene muchas aplicaciones en cinética de superficies (generalmente llamada cinética de Langmuir-Hinshelwood ) y termodinámica .
Langmuir sugirió que la adsorción se produce a través de este mecanismo: , donde A es una molécula de gas y S es un sitio de adsorción. Las constantes de velocidad directa e inversa son k y k −1 . Si definimos la cobertura de superficie, , como la fracción de los sitios de adsorción ocupados, en el equilibrio tenemos:
o
donde es la presión parcial del gas o la concentración molar de la solución. Para presiones muy bajas y para presiones altas .
El valor de es difícil de medir experimentalmente; por lo general, el adsorbato es un gas y la cantidad adsorbida se da en moles, gramos o volúmenes de gas a temperatura y presión estándar (STP) por gramo de adsorbente. Si llamamos v mon al volumen STP de adsorbato requerido para formar una monocapa sobre el adsorbente (por gramo de adsorbente), entonces , y obtenemos una expresión para una línea recta:
A través de su pendiente e intersección con el eje y podemos obtener v mon y K , que son constantes para cada par adsorbente-adsorbato a una temperatura dada. v mon está relacionado con el número de sitios de adsorción a través de la ley de los gases ideales . Si asumimos que el número de sitios es simplemente el área total del sólido dividida entre la sección transversal de las moléculas de adsorbato, podemos calcular fácilmente el área superficial del adsorbente. El área superficial de un adsorbente depende de su estructura: cuantos más poros tenga, mayor será el área, lo que tiene una gran influencia en las reacciones en las superficies .
Si más de un gas se adsorbe en la superficie, lo definimos como la fracción de sitios vacíos, y tenemos:
También podemos definir como la fracción de los sitios ocupados por el j -ésimo gas:
donde i es cada uno de los gases que se adsorben.
Nota:
1) Para elegir entre las ecuaciones de Langmuir y Freundlich, se deben investigar las entalpías de adsorción. [15] Mientras que el modelo de Langmuir supone que la energía de adsorción permanece constante con la ocupación de la superficie, la ecuación de Freundlich se deriva con la suposición de que el calor de adsorción disminuye continuamente a medida que se ocupan los sitios de unión. [16] La elección del modelo en función del mejor ajuste de los datos es un error común. [15]
2) El uso de la forma linealizada del modelo Langmuir ya no es una práctica común. Los avances en la capacidad computacional permitieron que la regresión no lineal se pudiera realizar rápidamente y con mayor confianza, ya que no se requiere transformación de datos.
A menudo, las moléculas forman multicapas, es decir, algunas se adsorben sobre moléculas ya adsorbidas, y la isoterma de Langmuir no es válida. En 1938, Stephen Brunauer , Paul Emmett y Edward Teller desarrollaron una isoterma modelo que tiene en cuenta esa posibilidad. Su teoría se llama teoría BET , por las iniciales de sus apellidos. Modificaron el mecanismo de Langmuir de la siguiente manera:

La derivación de la fórmula es más complicada que la de Langmuir (ver enlaces para la derivación completa). Obtenemos:
donde x es la presión dividida por la presión de vapor del adsorbato a esa temperatura (generalmente denotada como ), v es el volumen STP del adsorbato adsorbido, vmon es el volumen STP de la cantidad de adsorbato requerida para formar una monocapa y c es la constante de equilibrio K que usamos en la isoterma de Langmuir multiplicada por la presión de vapor del adsorbato. La suposición clave utilizada para derivar la ecuación BET es que los calores sucesivos de adsorción para todas las capas excepto la primera son iguales al calor de condensación del adsorbato.
La isoterma de Langmuir suele ser mejor para la quimisorción, y la isoterma BET funciona mejor para la fisisorción de superficies no microporosas.

En otros casos, las interacciones moleculares entre moléculas de gas previamente adsorbidas en una superficie sólida forman interacciones significativas con moléculas de gas en las fases gaseosas. Por lo tanto, es más probable que la adsorción de moléculas de gas a la superficie ocurra alrededor de moléculas de gas que ya están presentes en la superficie sólida, lo que hace que la isoterma de adsorción de Langmuir sea ineficaz para los fines de modelado. Este efecto fue estudiado en un sistema donde el nitrógeno era el adsorbato y el tungsteno era el adsorbente por Paul Kisliuk (1922-2008) en 1957. [17] Para compensar la mayor probabilidad de que se produzca la adsorción alrededor de las moléculas presentes en la superficie del sustrato, Kisliuk desarrolló la teoría del estado precursor, por la cual las moléculas entrarían en un estado precursor en la interfaz entre el adsorbente sólido y el adsorbato en la fase gaseosa. A partir de aquí, las moléculas de adsorbato se adsorberían al adsorbente o se desorberían en la fase gaseosa. La probabilidad de que se produzca adsorción desde el estado precursor depende de la proximidad del adsorbato a otras moléculas de adsorbato que ya se han adsorbido. Si la molécula de adsorbato en el estado precursor está muy próxima a una molécula de adsorbato que ya se ha formado en la superficie, tiene una probabilidad de adherencia reflejada por el tamaño de la constante S E y se adsorberá desde el estado precursor a una velocidad de k EC o se desorberá en la fase gaseosa a una velocidad de k ES . Si una molécula de adsorbato entra en el estado precursor en una ubicación alejada de cualquier otra molécula de adsorbato previamente adsorbida, la probabilidad de adherencia se refleja por el tamaño de la constante S D .
Estos factores se incluyeron como parte de una única constante denominada "coeficiente de adherencia", k E , que se describe a continuación:
Como SD está determinada por factores que se tienen en cuenta en el modelo de Langmuir, se puede suponer que SD es la constante de velocidad de adsorción. Sin embargo, la constante de velocidad para el modelo de Kisliuk ( R ') es diferente de la del modelo de Langmuir, ya que R ' se utiliza para representar el impacto de la difusión en la formación de monocapas y es proporcional a la raíz cuadrada del coeficiente de difusión del sistema. La isoterma de adsorción de Kisliuk se escribe de la siguiente manera, donde θ ( t ) es la cobertura fraccionaria del adsorbente con adsorbato y t es el tiempo de inmersión:
Resolviendo para θ ( t ) obtenemos:
Las constantes de adsorción son constantes de equilibrio , por lo tanto obedecen a la ecuación de Van 't Hoff :
Como se puede observar en la fórmula, la variación de K debe ser isostérica, es decir, a cobertura constante. Si partimos de la isoterma BET y suponemos que el cambio de entropía es el mismo para la licuefacción y la adsorción, obtenemos
es decir, la adsorción es más exotérmica que la licuefacción.
La adsorción de moléculas de un conjunto sobre una superficie o interfaz se puede dividir en dos procesos: adsorción y desorción. Si la tasa de adsorción supera a la tasa de desorción, las moléculas se acumularán con el tiempo dando la curva de adsorción a lo largo del tiempo. Si la tasa de desorción es mayor, el número de moléculas sobre la superficie disminuirá con el tiempo. La tasa de adsorción depende de la temperatura, la tasa de difusión del soluto (relacionada con el camino libre medio para el gas puro) y la barrera de energía entre la molécula y la superficie. La difusión y los elementos clave de la tasa de adsorción se pueden calcular utilizando las leyes de difusión de Fick y la relación de Einstein (teoría cinética) . En condiciones ideales, cuando no hay barrera de energía y todas las moléculas que se difunden y chocan con la superficie se adsorben, el número de moléculas adsorbidas en una superficie de área sobre una superficie de área infinita se puede integrar directamente a partir de la ecuación diferencial de la segunda ley de Fick para ser: [18]
donde es el área superficial (unidad m 2 ), es la concentración numérica de la molécula en la solución a granel (unidad #/m 3 ), es la constante de difusión (unidad m 2 /s), y es el tiempo (unidad s). Simulaciones y análisis adicionales de esta ecuación [19] muestran que la dependencia de la raíz cuadrada del tiempo se origina a partir de la disminución de las concentraciones cerca de la superficie en condiciones ideales de adsorción. Además, esta ecuación solo funciona para el comienzo de la adsorción cuando se forma un gradiente de concentración de buen comportamiento cerca de la superficie. La corrección de la reducción del área de adsorción y la desaceleración de la evolución del gradiente de concentración deben considerarse durante un tiempo más largo. [20] En condiciones experimentales reales, el flujo y el área de adsorción pequeña siempre hacen que la tasa de adsorción sea más rápida que lo que predijo esta ecuación, y la barrera de energía acelerará esta tasa por atracción de la superficie o la ralentizará por repulsión de la superficie. Por lo tanto, la predicción de esta ecuación a menudo está a unos pocos o varios órdenes de magnitud de distancia de los resultados experimentales. En casos especiales, como un área de adsorción muy pequeña en una superficie grande y en equilibrio químico cuando no hay gradiente de concentración cerca de la superficie, esta ecuación se vuelve útil para predecir la tasa de adsorción con especial cuidado para determinar un valor específico en una medición particular. [19]
La desorción de una molécula de la superficie depende de la energía de unión de la molécula a la superficie y de la temperatura. Por lo tanto, la tasa de adsorción total típica suele ser un resultado combinado de la adsorción y la desorción.
Desde 1980 se han elaborado dos teorías para explicar la adsorción y obtener ecuaciones que funcionen. Estas dos teorías se conocen como la hipótesis chi, la derivación mecánica cuántica y el trabajo superficial excesivo (ESW). [21] Ambas teorías arrojan la misma ecuación para superficies planas:
donde U es la función escalón unitario. Las definiciones de los demás símbolos son las siguientes:
donde "ads" significa "adsorbido", "m" significa "equivalencia de monocapa" y "vap" es una referencia a la presión de vapor del líquido adsorbente a la misma temperatura que la muestra sólida. La función de unidad crea la definición de la energía molar de adsorción para la primera molécula adsorbida mediante:
El gráfico de la relación adsorbida versus se denomina gráfico de chi. Para superficies planas, la pendiente del gráfico de chi proporciona el área de la superficie. Empíricamente, Michael Polanyi [22] [23] [24] y también Jan Hendrik de Boer y Cornelis Zwikker [25] observaron que este gráfico se ajustaba muy bien a la isoterma , pero no se siguió haciéndolo. Esto se debió a las críticas en el primer caso de Albert Einstein y en el segundo caso de Brunauer. Esta ecuación de superficie plana se puede utilizar como una "curva estándar" en la tradición normal de las curvas de comparación, con la excepción de que la parte inicial del gráfico de la relación adsorbida de la muestra porosa actúa como un autoestándar. Las condiciones ultramicroporosas, microporosas y mesoporosas se pueden analizar utilizando esta técnica. Las desviaciones estándar típicas para los ajustes completos de la isoterma, incluidas las muestras porosas, son inferiores al 2 %.
Nótese que en esta descripción de la adsorción física, la entropía de adsorción es consistente con el criterio termodinámico de Dubinin, es decir, la entropía de adsorción del estado líquido al estado adsorbido es aproximadamente cero.

Los adsorbentes se utilizan generalmente en forma de gránulos esféricos, varillas, molduras o monolitos con un radio hidrodinámico de entre 0,25 y 5 mm. Deben tener una alta resistencia a la abrasión , una alta estabilidad térmica y diámetros de poro pequeños, lo que da como resultado una mayor área de superficie expuesta y, por lo tanto, una alta capacidad de adsorción. Los adsorbentes también deben tener una estructura de poro distintiva que permita el transporte rápido de los vapores gaseosos. [26] La mayoría de los adsorbentes industriales se dividen en tres clases:

El gel de sílice es una forma amorfa de SiO2 químicamente inerte, no tóxica, polar y dimensionalmente estable (<400 °C o 750 °F) . Se prepara mediante la reacción entre el silicato de sodio y el ácido acético, seguida de una serie de procesos de postratamiento, como envejecimiento, decapado, etc. Estos métodos de postratamiento dan como resultado diversas distribuciones de tamaño de poro.
La sílice se utiliza para el secado del aire de proceso (por ejemplo, oxígeno, gas natural) y la adsorción de hidrocarburos pesados (polares) del gas natural.
Las zeolitas son aluminosilicatos cristalinos naturales o sintéticos que tienen una red de poros repetitivos y liberan agua a altas temperaturas. Las zeolitas son de naturaleza polar.
Se fabrican mediante síntesis hidrotermal de aluminosilicato de sodio u otra fuente de sílice en un autoclave seguido de intercambio iónico con ciertos cationes (Na + , Li + , Ca2 + , K + , NH4 + ) . El diámetro del canal de las jaulas de zeolita suele oscilar entre 2 y 9 Å . El proceso de intercambio iónico va seguido del secado de los cristales, que pueden peletizarse con un aglutinante para formar pellets macroporosos.
Las zeolitas se aplican en el secado de aire de proceso, la eliminación de CO2 del gas natural, la eliminación de CO del gas de reformado, la separación de aire, el craqueo catalítico y la síntesis y reformado catalíticos.
Las zeolitas no polares (silíceas) se sintetizan a partir de fuentes de sílice sin aluminio o mediante la desaluminación de zeolitas que contienen aluminio. El proceso de desaluminación se realiza mediante el tratamiento de la zeolita con vapor a temperaturas elevadas, normalmente superiores a 500 °C (930 °F). Este tratamiento térmico a alta temperatura rompe los enlaces de aluminio y oxígeno y el átomo de aluminio se expulsa de la estructura de la zeolita.
El término "adsorción" fue acuñado por Heinrich Kayser en 1881 en el contexto de la absorción de gases por los carbonos. [28]
El carbón activado es un sólido amorfo y muy poroso, formado por microcristales con una red de grafito, que se suele preparar en forma de pequeñas pastillas o en polvo. Es apolar y barato. Uno de sus principales inconvenientes es que reacciona con el oxígeno a temperaturas moderadas (superiores a 300 °C).

El carbón activado se puede fabricar a partir de material carbonoso, incluido el carbón (bituminoso, subbituminoso y lignito), turba, madera o cáscaras de frutos secos (por ejemplo, coco). El proceso de fabricación consta de dos fases, carbonización y activación. [29] [30] El proceso de carbonización incluye el secado y el calentamiento para separar los subproductos, incluidos los alquitranes y otros hidrocarburos de la materia prima, así como para eliminar los gases generados. El proceso se completa calentando el material a más de 400 °C (750 °F) en una atmósfera libre de oxígeno que no puede soportar la combustión. Las partículas carbonizadas se "activan" exponiéndolas a un agente oxidante, generalmente vapor o dióxido de carbono a alta temperatura. Este agente quema las estructuras de bloqueo de poros creadas durante la fase de carbonización y, por lo tanto, desarrollan una estructura reticular de grafito tridimensional porosa. El tamaño de los poros desarrollados durante la activación es una función del tiempo que pasan en esta etapa. Los tiempos de exposición más prolongados dan como resultado tamaños de poro más grandes. Los carbones de fase acuosa más populares son de base bituminosa debido a su dureza, resistencia a la abrasión, distribución del tamaño de poro y bajo costo, pero su eficacia debe probarse en cada aplicación para determinar el producto óptimo.
El carbón activado se utiliza para la adsorción de sustancias orgánicas [31] y adsorbentes no polares y también se utiliza habitualmente para el tratamiento de gases residuales (y aguas residuales). Es el adsorbente más utilizado, ya que la mayoría de sus propiedades químicas (por ejemplo, grupos de superficie) y físicas (por ejemplo, distribución del tamaño de poro y área de superficie) se pueden ajustar según lo que se necesite. [32] Su utilidad también se deriva de su gran volumen de microporos (y a veces mesoporos) y la gran área de superficie resultante. Investigaciones recientes informaron que el carbón activado es un agente eficaz para adsorber especies catiónicas de metales tóxicos de sistemas multicontaminantes y también propusieron posibles mecanismos de adsorción con evidencias de respaldo. [33]
La adsorción de agua en superficies es de gran importancia en ingeniería química , ciencia de materiales y catálisis . También denominada hidratación superficial, la presencia de agua adsorbida física o químicamente en las superficies de los sólidos desempeña un papel importante en la regulación de las propiedades de la interfaz, las vías de reacción química y el rendimiento catalítico en una amplia gama de sistemas. En el caso del agua adsorbida físicamente, la hidratación superficial se puede eliminar simplemente mediante el secado en condiciones de temperatura y presión que permitan la vaporización completa del agua. Para el agua adsorbida químicamente, la hidratación puede ser en forma de adsorción disociativa , donde las moléculas de H 2 O se disocian en -H y -OH adsorbidos en la superficie, o adsorción molecular (adsorción asociativa) donde las moléculas de agua individuales permanecen intactas [34]
El bajo costo ($200/tonelada) y la alta tasa de ciclo (2000 ×) de las zeolitas sintéticas como Linde 13X con adsorbato de agua han despertado mucho interés académico y comercial recientemente para su uso en el almacenamiento de energía térmica (TES), específicamente de calor solar y residual de baja calidad. Se han financiado varios proyectos piloto en la UE desde 2000 hasta la actualidad (2020). [ cita requerida ] El concepto básico es almacenar energía solar térmica como energía química latente en la zeolita. Por lo general, se hace fluir aire caliente y seco de colectores solares de placa plana a través de un lecho de zeolita de modo que se elimine cualquier adsorbato de agua presente. El almacenamiento puede ser diurno, semanal, mensual o incluso estacional según el volumen de la zeolita y el área de los paneles solares térmicos. Cuando se necesita calor durante la noche, o en horas sin sol, o en invierno, el aire humidificado fluye a través de la zeolita. A medida que la humedad es absorbida por la zeolita, el calor se libera al aire y, posteriormente, al espacio del edificio. Esta forma de TES, con uso específico de zeolitas, fue enseñada por primera vez por John Guerra en 1978. [35]
Los adsorbentes típicos propuestos para la captura y almacenamiento de carbono son las zeolitas y los MOF . [36] La personalización de los adsorbentes los convierte en una alternativa potencialmente atractiva a la absorción. Debido a que los adsorbentes se pueden regenerar mediante cambios de temperatura o presión, este paso puede requerir menos energía que los métodos de regeneración por absorción . [37] Los principales problemas que se presentan con el costo de la adsorción en la captura de carbono son: regeneración del adsorbente, relación de masa, solvente/MOF, costo del adsorbente, producción del adsorbente, vida útil del adsorbente. [38]
En la tecnología de desplazamiento de gas de agua mejorado por sorción (SEWGS) se combina un proceso de captura de carbono de precombustión, basado en la adsorción de sólidos, con la reacción de desplazamiento de gas de agua (WGS) para producir una corriente de hidrógeno a alta presión. [39] La corriente de CO2 producida se puede almacenar o utilizar para otros procesos industriales. [40]
La adsorción de proteínas es un proceso que tiene un papel fundamental en el campo de los biomateriales . De hecho, las superficies de los biomateriales en contacto con medios biológicos, como la sangre o el suero, quedan inmediatamente recubiertas de proteínas. Por lo tanto, las células vivas no interactúan directamente con la superficie del biomaterial, sino con la capa de proteínas adsorbidas. Esta capa de proteínas media la interacción entre los biomateriales y las células, traduciendo las propiedades físicas y químicas del biomaterial a un "lenguaje biológico". [41] De hecho, los receptores de la membrana celular se unen a los sitios bioactivos de la capa de proteínas y estos eventos de unión receptor-proteína se transducen, a través de la membrana celular, de una manera que estimula procesos intracelulares específicos que luego determinan la adhesión, forma, crecimiento y diferenciación celular. La adsorción de proteínas está influenciada por muchas propiedades de la superficie, como la humectabilidad de la superficie , la composición química de la superficie [42] y la morfología de la superficie a escala nanométrica. [43] La adsorción de surfactante es un fenómeno similar, pero utilizando moléculas de surfactante en lugar de proteínas. [44]
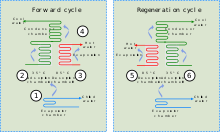
Los enfriadores de adsorción combinan un adsorbente con un refrigerante y utilizan calor para generar un efecto de enfriamiento. Este calor, en forma de agua caliente, puede provenir de diversas fuentes industriales, incluido el calor residual de procesos industriales, el calor primario de instalaciones solares térmicas o el calor de escape o de la camisa de agua de un motor de pistón o una turbina.
Aunque existen similitudes entre los enfriadores de adsorción y la refrigeración por absorción , el primero se basa en la interacción entre gases y sólidos. La cámara de adsorción del enfriador está llena de un material sólido (por ejemplo, zeolita, gel de sílice, alúmina, carbón activo o ciertos tipos de sales metálicas), que en su estado neutro ha adsorbido el refrigerante. Cuando se calienta, el sólido desorbe (libera) vapor de refrigerante, que posteriormente se enfría y se licúa. Este refrigerante líquido proporciona entonces un efecto de enfriamiento en el evaporador a partir de su entalpía de vaporización . En la etapa final, el vapor de refrigerante se (re)adsorbe en el sólido. [45] Como un enfriador de adsorción no requiere compresor, es relativamente silencioso.
La adsorción mediada por sitios portales es un modelo para la adsorción de gas activado selectiva por sitio en sistemas catalíticos metálicos que contienen una variedad de sitios de adsorción diferentes. En tales sistemas, los sitios de baja coordinación con defectos de "borde y esquina" pueden exhibir entalpías de adsorción significativamente más bajas que los sitios de alta coordinación ( plano basal ). Como resultado, estos sitios pueden servir como "portales" para una adsorción muy rápida al resto de la superficie. El fenómeno se basa en el efecto común de "desbordamiento" (descrito a continuación), donde ciertas especies adsorbidas exhiben alta movilidad en algunas superficies. El modelo explica observaciones aparentemente inconsistentes de la termodinámica y la cinética de la adsorción de gas en sistemas catalíticos donde las superficies pueden existir en un rango de estructuras de coordinación, y se ha aplicado con éxito a sistemas catalíticos bimetálicos donde se observa actividad sinérgica.
A diferencia del derrame puro, la adsorción en el sitio portal se refiere a la difusión superficial hacia sitios de adsorción adyacentes, no a superficies de soporte no adsorbentes.
El modelo parece haber sido propuesto por primera vez para el monóxido de carbono sobre platino soportado en sílice por Brandt et al. (1993). [46] Un modelo similar, pero independiente fue desarrollado por King y colaboradores [47] [48] [49] para describir la adsorción de hidrógeno sobre catalizadores bimetálicos de rutenio, plata-rutenio y cobre-rutenio promovidos por álcali soportados en sílice. El mismo grupo aplicó el modelo a la hidrogenación de CO ( síntesis de Fischer-Tropsch ). [50] Zupanc et al. (2002) confirmaron posteriormente el mismo modelo para la adsorción de hidrógeno sobre catalizadores bimetálicos de cesio-rutenio soportados en magnesia. [51] Trens et al. (2009) han descrito de forma similar la difusión superficial de CO sobre partículas de Pt soportadas en carbono de morfología variable. [52]
En el caso de sistemas catalíticos o adsorbentes en los que una especie metálica se dispersa sobre un material de soporte (o portador) (a menudo óxidos cuasi-inertes, como alúmina o sílice), es posible que una especie adsorbente se adsorba indirectamente a la superficie del soporte en condiciones en las que dicha adsorción es termodinámicamente desfavorable. La presencia del metal sirve como una vía de menor energía para que las especies gaseosas se adsorban primero al metal y luego se difunden sobre la superficie del soporte. Esto es posible porque las especies adsorbidas alcanzan un estado de energía más bajo una vez que se han adsorbido al metal, lo que reduce la barrera de activación entre las especies en fase gaseosa y las especies adsorbidas al soporte.
El derrame de hidrógeno es el ejemplo más común de derrame por adsorción. En el caso del hidrógeno, la adsorción suele ir acompañada de una disociación del hidrógeno molecular (H2 ) en hidrógeno atómico (H), seguida del derrame de los átomos de hidrógeno presentes.
El efecto de derrame se ha utilizado para explicar muchas observaciones en catálisis heterogénea y adsorción. [53]
La adsorción de moléculas sobre superficies de polímeros es fundamental para diversas aplicaciones, entre ellas el desarrollo de recubrimientos antiadherentes y diversos dispositivos biomédicos. Los polímeros también pueden adsorberse a superficies mediante adsorción de polielectrolitos .
La adsorción es el primer paso del ciclo de vida del virus . Los siguientes pasos son la penetración, la desprotección, la síntesis (transcripción, si es necesaria, y traducción) y la liberación. El ciclo de replicación del virus, en este sentido, es similar para todos los tipos de virus. Factores como la transcripción pueden ser necesarios o no si el virus es capaz de integrar su información genómica en el núcleo de la célula, o si el virus puede replicarse directamente dentro del citoplasma de la célula.
El juego de Tetris es un juego de rompecabezas en el que bloques de 4 se adsorben sobre una superficie durante el juego. Los científicos han utilizado bloques de Tetris "como un sustituto de moléculas con una forma compleja" y su "adsorción sobre una superficie plana" para estudiar la termodinámica de las nanopartículas . [54] [55]
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )[ página necesaria ]