La uroquinasa , también conocida como activador del plasminógeno de tipo uroquinasa ( uPA ), es una serina proteasa presente en humanos y otros animales. La proteína uroquinasa humana fue descubierta, pero no nombrada, por McFarlane y Pilling en 1947. [5] La uroquinasa se aisló originalmente de la orina humana y también está presente en la sangre y en la matriz extracelular de muchos tejidos. El principal sustrato fisiológico de esta enzima es el plasminógeno , que es una forma inactiva ( zimógeno ) de la serina proteasa plasmina . La activación de la plasmina desencadena una cascada proteolítica que, dependiendo del entorno fisiológico, participa en la trombólisis o degradación de la matriz extracelular. Esta cascada había estado implicada en enfermedades vasculares y en la progresión del cáncer. [6]
La uroquinasa está codificada en humanos por el gen PLAU , que significa "activador del plasminógeno, uroquinasa". [7] El mismo símbolo representa el gen en otras especies animales.
El gen PLAU codifica una serina proteasa ( EC 3.4.21.73) implicada en la degradación de la matriz extracelular y posiblemente en la migración y proliferación de células tumorales. Un polimorfismo específico en este gen puede estar asociado con la enfermedad de Alzheimer de aparición tardía y también con una menor afinidad por la unión de fibrina. La proteína codificada por este gen convierte el plasminógeno en plasmina mediante la escisión específica de un enlace Arg-Val en el plasminógeno. La proproteína de este gen se escinde en un enlace Lys-Ile por la plasmina para formar un derivado de dos cadenas en el que un único enlace disulfuro conecta la cadena A amino-terminal con la cadena B carboxi-terminal catalíticamente activa. Este derivado de dos cadenas también se denomina HMW-uPA (uPA de alto peso molecular). HMW-uPA se puede procesar adicionalmente en LMW-uPA (uPA de bajo peso molecular) mediante la escisión de la cadena A en una cadena corta A (A1) y un fragmento amino terminal. LMW-uPA es proteolíticamente activo pero no se une al receptor de uPA. [8]
La uroquinasa es una proteína de 411 residuos , que consta de tres dominios : el dominio serina proteasa (que consta de los residuos 159-411), el dominio kringle (que consta de los residuos 50-131) y el dominio similar a EGF (que consta de los residuos 1- 49). El dominio kringle y el dominio de serina proteasa están conectados por un conector entre dominios o péptido conector (que consta de los residuos 132-158). La uroquinasa se sintetiza como una forma de zimógeno (prouroquinasa o uroquinasa monocatenaria) y se activa mediante escisión proteolítica entre Lys158 e Ile159. Las dos cadenas resultantes se mantienen juntas mediante un enlace disulfuro entre Cys148 y Cys279. [9]
En comparación con el sistema de los mamíferos, el pez cebra (Danio rerio) contiene dos ortólogos de uroquinasa que se han caracterizado como zfuPA-a y zfuPA-b. zfuPA-a se diferencia del uPA de mamíferos por carecer de una secuencia de exón que codifique el dominio de unión de uPAR (receptor de uroquinasa); mientras que el zfuPA-b carece de dos cisteínas del dominio similar al factor de crecimiento epidérmico. zfuPA-b tampoco tiene actividad de unión en los glóbulos blancos de pescado ni en líneas celulares de pescado. La unión de uPAR en el sistema de los mamíferos es esencial para la actividad de la uroquinasa y uPAR, ya que también funciona como receptor de adhesión debido a su afinidad por la vitronectina , las integrinas y otras proteasas como PAI-1 . La falta de la región de unión de uPAR en el uPA del pez cebra sugiere que el uPA del pez cebra funciona sin unión de uPAR. [10]
Los inhibidores más importantes de la uroquinasa son las serpinas , el inhibidor 1 del activador del plasminógeno (PAI-1) y el inhibidor 2 del activador del plasminógeno (PAI-2), que inhiben la actividad de la proteasa de forma irreversible. En la matriz extracelular, la uroquinasa está unida a la membrana celular mediante su interacción con el receptor de uroquinasa .
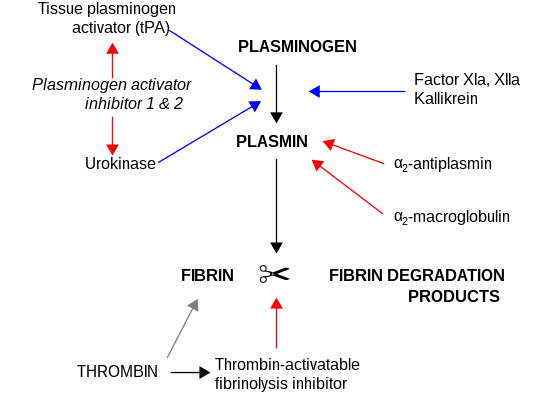
uPa también interactúa con el inhibidor de la proteína C. [11] [12]
zfuPA-a y zfuPA-b son pobres activadores del plasminógeno humano , mientras que el uPA humano es un pobre activador del plasminógeno del salmón . La principal diferencia entre la uPA del pez cebra y la uPA humana está en el dominio EGF. [10]
Se ha encontrado que los niveles elevados de expresión de uroquinasa y varios otros componentes del sistema de activación del plasminógeno se correlacionan con la malignidad del tumor . Se cree que la degradación del tejido tras la activación del plasminógeno facilita la invasión del tejido y, por tanto, contribuye a la metástasis . [13] El activador del plasminógeno de tipo uroquinasa (uPA) se asocia más comúnmente con la progresión del cáncer que el activador del plasminógeno tisular (tPA). [14] Esto convierte al uPA en un objetivo farmacológico atractivo y, por lo tanto, se ha buscado el uso de inhibidores como agentes anticancerígenos. [15] [16] Sin embargo, las incompatibilidades entre los sistemas humano y murino dificultan la evaluación clínica de estos agentes. Además, las células normales utilizan la uroquinasa para la remodelación de tejidos y el crecimiento de vasos, lo que requiere distinguir las características de la uroquinasa asociadas al cáncer para un objetivo específico. [13]
La degradación de la matriz extracelular por uPA es crucial para iniciar la angiogénesis asociada con el crecimiento del cáncer. [14]
El antígeno uPA está elevado en el tejido del cáncer de mama, lo que se correlaciona con un mal pronóstico en pacientes con cáncer de mama. [14] Por esta razón, el uPA se puede utilizar como biomarcador de diagnóstico en el cáncer de mama. [14]
A través de su interacción con el receptor de uroquinasa , la uroquinasa afecta varios otros aspectos de la biología del cáncer, como la adhesión celular, la migración y las vías mitóticas celulares .
Al 7 de diciembre de 2012, Mesupron ( upamostat ), un inhibidor de serina proteasa de molécula pequeña desarrollado por la compañía farmacéutica WILEX, completó los ensayos de fase II. [17] Mesupron parece ser seguro cuando se combina con el fármaco quimioterapéutico Capecitabina para la supervivencia libre de progresión en el cáncer de mama humano. [18]
La uroquinasa es eficaz para restablecer el flujo a los catéteres intravenosos bloqueados por sangre coagulada o fibrina (aclaramiento del catéter). Los catéteres se utilizan ampliamente para administrar tratamientos a pacientes con fines tales como diálisis, nutrición, tratamiento con antibióticos y tratamiento del cáncer. Aproximadamente el 25% de los catéteres se bloquean, lo que significa que los pacientes afectados no pueden recibir tratamiento hasta que el catéter se haya limpiado o reemplazado. La uroquinasa también se usa clínicamente como agente trombolítico en el tratamiento de trombosis venosa profunda grave o masiva , enfermedad oclusiva arterial periférica, embolia pulmonar , infarto agudo de miocardio (IAM, ataque cardíaco) y cánulas de diálisis ocluidas (limpieza del catéter). También se administra por vía intrapleural para mejorar el drenaje de derrames pleurales complicados y empiemas. La uroquinasa se comercializa como Kinlytic (antes Abbokinase) y compite con el activador del plasminógeno tisular recombinante (p. ej., alteplasa) como fármaco trombolítico.
Todos los activadores del plasminógeno (uroquinasa, tPA) catalizan la producción de plasmina, lo que a su vez conduce a la ruptura de la estructura de malla de fibrina en los coágulos sanguíneos. Si bien existen puntos en común en el modo de acción de la uroquinasa y el tPA, la uroquinasa tiene algunas ventajas para el tratamiento de coágulos periféricos (embolia pulmonar, trombosis venosa profunda, enfermedad oclusiva arterial periférica).
A diferencia del tPA, que se activa uniéndose a la fibrina dentro de los coágulos, la uroquinasa no es secuestrada por la fibrina y, por lo tanto, no ataca específicamente a los coágulos hemostáticos. Esto hace que sea menos probable que la uroquinasa descomponga los coágulos hemostáticos que son esenciales para la reparación continua de los vasos sanguíneos en todo el cuerpo. La disolución de estos coágulos "buenos" puede provocar eventos adversos graves como sangrado hemorrágico. Años de estudios clínicos han confirmado la ventaja de seguridad del uso de uroquinasa. [19] [20] En consecuencia, la uroquinasa se ha utilizado preferentemente en la trombosis venosa profunda y la enfermedad oclusiva arterial periférica, donde se administra directamente en el sitio del coágulo, mientras que se prefiere el tPA en el IAM, donde la hemorragia periférica es una consideración secundaria.
Evelyn Nicol patentó un método revolucionario para la producción de uroquinasa en 1976 (patente estadounidense nº 3.930.944). Se creía que Nicol era la primera mujer afroamericana en recibir una patente de biología molecular. [21]
La presencia de una enzima fibrinolítica en la orina humana se informó en 1947, sin que se le diera un nombre a dicha enzima detrás de su efecto. [22] En 1952 se extrajo una forma purificada de la enzima de la orina humana y se la denominó "uroquinasa" por "quinasa urinaria". [23] El texto completo de este artículo se ha perdido y la única cita apunta al resumen de una lista de artículos leídos en una conferencia en la misma revista. [24] Algunos otros artículos sobre la purificación se publicaron de forma independiente aproximadamente al mismo tiempo. En 1960, todavía no estaba claro si la activación del plasminógeno tenía algo que ver con una proteasa, pero se cree que una quinasa desempeña un papel de todos modos. [25]
La orina normal de humanos y perros contiene fibrinolisina (plasmina) y un potente activador de profibrinolisina (plasminógeno).
El activador, al que hemos denominado uroquinasa, se puede concentrar y purificar parcialmente mediante métodos de fraccionamiento con acetona o alcohol.