
La adsorción es la adhesión [1] de átomos , iones o moléculas de un gas, líquido o sólido disuelto a una superficie . [2] Este proceso crea una película del adsorbato en la superficie del adsorbente . Este proceso se diferencia de la absorción , en la que un fluido (el absorbido ) se disuelve o penetra en un líquido o sólido (el absorbente ). [3] Si bien la adsorción a menudo precede a la absorción, que implica la transferencia del absorbato al volumen del material absorbente, alternativamente, la adsorción es claramente un fenómeno superficial, en el que el adsorbato no penetra a través de la superficie del material ni en la mayor parte del material absorbente. adsorbente. [4] El término sorción abarca tanto la adsorción como la absorción, y la desorción es lo opuesto a la sorción.
Al igual que la tensión superficial , la adsorción es una consecuencia de la energía superficial . En un material a granel, todos los requisitos de enlace (ya sean iónicos , covalentes o metálicos ) de los átomos constituyentes del material los cumplen otros átomos del material. Sin embargo, los átomos en la superficie del adsorbente no están completamente rodeados por otros átomos del adsorbente y, por lo tanto, pueden atraer adsorbatos. La naturaleza exacta del enlace depende de los detalles de las especies involucradas, pero el proceso de adsorción generalmente se clasifica como fisisorción (característica de las fuerzas débiles de van der Waals ) o quimisorción (característica del enlace covalente). También puede ocurrir debido a la atracción electrostática. [5] [6] La naturaleza de la adsorción puede afectar la estructura de las especies adsorbidas. Por ejemplo, la fisisorción de polímeros a partir de una solución puede provocar estructuras aplastadas en una superficie. [7]
La adsorción está presente en muchos sistemas naturales, físicos, biológicos y químicos y se usa ampliamente en aplicaciones industriales como catalizadores heterogéneos , [8] [9] carbón activado , captura y uso de calor residual para proporcionar agua fría para aire acondicionado y otros requisitos de proceso. (enfriadores de adsorción), resinas sintéticas , aumento de la capacidad de almacenamiento de carbones derivados de carburos y purificación de agua . La adsorción, el intercambio iónico y la cromatografía son procesos de sorción en los que ciertos adsorbatos se transfieren selectivamente desde la fase fluida a la superficie de partículas rígidas e insolubles suspendidas en un recipiente o empaquetadas en una columna. Las aplicaciones de la industria farmacéutica, que utilizan la adsorción como un medio para prolongar la exposición neurológica a medicamentos específicos o partes de ellos, [ cita necesaria ] son menos conocidas.
La palabra "adsorción" fue acuñada en 1881 por el físico alemán Heinrich Kayser (1853-1940). [10]
La adsorción de gases y solutos suele describirse mediante isotermas, es decir, la cantidad de adsorbato sobre el adsorbente en función de su presión (si es gas) o concentración (para solutos en fase líquida) a temperatura constante. La cantidad adsorbida casi siempre está normalizada por la masa del adsorbente para permitir la comparación de diferentes materiales. Hasta la fecha se han desarrollado 15 modelos isotérmicos diferentes. [11]
El primer ajuste matemático a una isoterma fue publicado por Freundlich y Kuster (1906) y es una fórmula puramente empírica para adsorbatos gaseosos:
donde es la masa de adsorbato adsorbido, es la masa del adsorbente, es la presión del adsorbato (esto se puede cambiar a concentración si se investiga una solución en lugar de un gas) y son constantes empíricas para cada par adsorbente-adsorbato a una temperatura determinada . La función no es adecuada a presiones muy altas porque en realidad tiene un máximo asintótico a medida que la presión aumenta sin límite. A medida que aumenta la temperatura, las constantes y cambian para reflejar la observación empírica de que la cantidad adsorbida aumenta más lentamente y se requieren presiones más altas para saturar la superficie.
Irving Langmuir fue el primero en derivar una isoterma de adsorción con base científica en 1918. [12] El modelo se aplica a gases adsorbidos en superficies sólidas. Es una isoterma semiempírica con base cinética y se derivó basándose en la termodinámica estadística. Es la ecuación isotérmica más común de utilizar debido a su simplicidad y su capacidad para adaptarse a una variedad de datos de adsorción. Se basa en cuatro supuestos:
Estas cuatro suposiciones rara vez son todas ciertas: siempre hay imperfecciones en la superficie, las moléculas adsorbidas no son necesariamente inertes y el mecanismo claramente no es el mismo para las primeras moléculas que se adsorben en una superficie que para las últimas. La cuarta condición es la más problemática, ya que con frecuencia se adsorberán más moléculas en la monocapa; este problema se soluciona mediante la isoterma BET para superficies relativamente planas (no microporosas ). No obstante, la isoterma de Langmuir es la primera opción para la mayoría de los modelos de adsorción y tiene muchas aplicaciones en cinética de superficies (generalmente llamada cinética de Langmuir-Hinshelwood ) y termodinámica .
Langmuir sugirió que la adsorción se produce mediante este mecanismo: , donde A es una molécula de gas y S es un sitio de adsorción. Las constantes de velocidad directa e inversa son k y k −1 . Si definimos la cobertura superficial, , como la fracción de los sitios de adsorción ocupados, en el equilibrio tenemos:
o
donde es la presión parcial del gas o la concentración molar de la solución. Para presiones muy bajas , y para presiones altas .
El valor de es difícil de medir experimentalmente; Por lo general, el adsorbato es un gas y la cantidad adsorbida se da en moles, gramos o volúmenes de gas a temperatura y presión estándar (STP) por gramo de adsorbente. Si llamamos v mon al volumen STP de adsorbato requerido para formar una monocapa sobre el adsorbente (por gramo de adsorbente), entonces , y obtenemos una expresión para una línea recta:
A través de su pendiente y su intercepción podemos obtener vmon y K , que son constantes para cada par adsorbente-adsorbato a una temperatura determinada. vmon está relacionado con el número de sitios de adsorción mediante la ley de los gases ideales . Si asumimos que el número de sitios es solo el área total del sólido dividida entre la sección transversal de las moléculas de adsorbato, podemos calcular fácilmente el área de superficie del adsorbente. El área superficial de un adsorbente depende de su estructura: cuanto más poros tiene, mayor es el área, lo que tiene una gran influencia en las reacciones en las superficies .
Si más de un gas se adsorbe en la superficie, lo definimos como la fracción de sitios vacíos, y tenemos:
Además, podemos definir como la fracción de los sitios ocupados por el j -ésimo gas:
donde i es cada uno de los gases que se adsorben.
Nota:
1) Para elegir entre las ecuaciones de Langmuir y Freundlich, se deben investigar las entalpías de adsorción. [13] Mientras que el modelo de Langmuir supone que la energía de adsorción permanece constante con la ocupación de la superficie, la ecuación de Freundlich se deriva con el supuesto de que el calor de adsorción disminuye continuamente a medida que se ocupan los sitios de unión. [14] La elección del modelo basado en el mejor ajuste de los datos es un error común. [13]
2) El uso de la forma linealizada del modelo de Langmuir ya no es una práctica común. Los avances en el poder computacional permitieron realizar la regresión no lineal con mayor rapidez y confianza, ya que no se requiere transformación de datos.
A menudo, las moléculas forman multicapas, es decir, algunas se adsorben en moléculas ya adsorbidas y la isoterma de Langmuir no es válida. En 1938 Stephen Brunauer , Paul Emmett y Edward Teller desarrollaron un modelo de isoterma que tiene en cuenta esa posibilidad. Su teoría se llama teoría BET , por las iniciales de sus apellidos. Modificaron el mecanismo de Langmuir de la siguiente manera:

La derivación de la fórmula es más complicada que la de Langmuir (ver enlaces para la derivación completa). Obtenemos:
donde x es la presión dividida por la presión de vapor del adsorbato a esa temperatura (normalmente denominada ), v es el volumen STP del adsorbato adsorbido, v mon es el volumen STP de la cantidad de adsorbato necesaria para formar una monocapa y c es la constante de equilibrio K que utilizamos en la isoterma de Langmuir multiplicada por la presión de vapor del adsorbato. El supuesto clave utilizado para derivar la ecuación BET es que los calores sucesivos de adsorción para todas las capas excepto la primera son iguales al calor de condensación del adsorbato.
La isoterma de Langmuir suele ser mejor para la quimisorción y la isoterma BET funciona mejor para la fisisorción en superficies no microporosas.

En otros casos, las interacciones moleculares entre moléculas de gas previamente adsorbidas en una superficie sólida forman interacciones significativas con moléculas de gas en las fases gaseosas. Por lo tanto, es más probable que la adsorción de moléculas de gas a la superficie ocurra alrededor de moléculas de gas que ya están presentes en la superficie sólida, lo que hace que la isoterma de adsorción de Langmuir sea ineficaz para los propósitos del modelado. Este efecto fue estudiado en un sistema donde el nitrógeno era el adsorbato y el tungsteno era el adsorbente por Paul Kisliuk (1922-2008) en 1957. [15] Para compensar la mayor probabilidad de que se produzca adsorción alrededor de las moléculas presentes en la superficie del sustrato, Kisliuk desarrolló la teoría del estado precursor, según la cual las moléculas entrarían en un estado precursor en la interfaz entre el adsorbente sólido y el adsorbato en la fase gaseosa. A partir de aquí, las moléculas de adsorbato se adsorberían en el adsorbente o se desorberían en la fase gaseosa. La probabilidad de que se produzca adsorción desde el estado precursor depende de la proximidad del adsorbato a otras moléculas de adsorbato que ya han sido adsorbidas. Si la molécula de adsorbato en el estado precursor está muy cerca de una molécula de adsorbato que ya se ha formado en la superficie, tiene una probabilidad de adherencia reflejada por el tamaño de la constante SE y será adsorbida desde el estado precursor a una velocidad de k EC o se desorberá en la fase gaseosa a una velocidad de k ES . Si una molécula de adsorbato entra en estado precursor en una ubicación alejada de cualquier otra molécula de adsorbato previamente adsorbida, la probabilidad de adherencia se refleja en el tamaño de la constante SD .
Estos factores se incluyeron como parte de una única constante denominada "coeficiente de adherencia", kE , que se describe a continuación:
Como S D está dictado por factores que se tienen en cuenta en el modelo de Langmuir, se puede suponer que S D es la constante de velocidad de adsorción. Sin embargo, la constante de velocidad para el modelo de Kisliuk ( R ') es diferente de la del modelo Langmuir, ya que R ' se utiliza para representar el impacto de la difusión en la formación de monocapas y es proporcional a la raíz cuadrada del coeficiente de difusión del sistema. La isoterma de adsorción de Kisliuk se escribe de la siguiente manera, donde θ ( t ) es la cobertura fraccionaria del adsorbente con adsorbato y t es el tiempo de inmersión:
Resolviendo para θ ( t ) se obtiene:
Las constantes de adsorción son constantes de equilibrio , por lo tanto obedecen a la ecuación de Van 't Hoff :
Como se puede observar en la fórmula, la variación de K debe ser isostérica, es decir, a cobertura constante. Si partimos de la isoterma BET y asumimos que el cambio de entropía es el mismo para licuefacción y adsorción, obtenemos
es decir, la adsorción es más exotérmica que la licuefacción.
La adsorción de un conjunto de moléculas sobre una superficie o interfaz se puede dividir en dos procesos: adsorción y desorción. Si la tasa de adsorción gana a la tasa de desorción, las moléculas se acumularán con el tiempo dando la curva de adsorción a lo largo del tiempo. Si la tasa de desorción es mayor, la cantidad de moléculas en la superficie disminuirá con el tiempo. La tasa de adsorción depende de la temperatura, la tasa de difusión del soluto (relacionada con el camino libre medio del gas puro) y la barrera energética entre la molécula y la superficie. La difusión y los elementos clave de la tasa de adsorción se pueden calcular utilizando las leyes de difusión de Fick y la relación de Einstein (teoría cinética) . En condiciones ideales, cuando no existe una barrera de energía y todas las moléculas que se difunden y chocan con la superficie se adsorben, el número de moléculas adsorbidas en una superficie de área infinita se puede integrar directamente a partir de la ecuación diferencial de la segunda ley de Fick para ser : [dieciséis]
donde es el área de superficie (unidad m 2 ), es la concentración numérica de la molécula en la solución a granel (unidad #/m 3 ), es la constante de difusión (unidad m 2 /s) y es el tiempo (unidad s). Simulaciones y análisis adicionales de esta ecuación [17] muestran que la dependencia de la raíz cuadrada con el tiempo se origina a partir de la disminución de las concentraciones cerca de la superficie bajo condiciones ideales de adsorción. Además, esta ecuación sólo funciona al comienzo de la adsorción cuando se forma un gradiente de concentración de buen comportamiento cerca de la superficie. La corrección de la reducción del área de adsorción y la desaceleración de la evolución del gradiente de concentración deben considerarse durante un tiempo más largo. [18] En condiciones experimentales reales, el flujo y el área de adsorción pequeña siempre hacen que la tasa de adsorción sea más rápida de lo que predice esta ecuación, y la barrera de energía acelerará esta tasa por atracción superficial o la ralentizará por repulsión superficial. Por lo tanto, la predicción de esta ecuación suele estar alejada de unos pocos o varios órdenes de magnitud de los resultados experimentales. En casos especiales, como un área de adsorción muy pequeña en una superficie grande, y en equilibrio químico cuando no hay gradiente de concentración cerca de la superficie, esta ecuación resulta útil para predecir la tasa de adsorción con un cuidado especial discutible para determinar un valor específico de en una medida determinada. [17]
La desorción de una molécula de la superficie depende de la energía de unión de la molécula a la superficie y de la temperatura. Por tanto, la tasa de adsorción general típica es a menudo un resultado combinado de la adsorción y la desorción.
Desde 1980 se trabajó en dos teorías para explicar la adsorción y obtener ecuaciones que funcionaran. Estas dos se conocen como la hipótesis chi, la derivación de la mecánica cuántica y el exceso de trabajo de superficie (ESW). [19] Ambas teorías producen la misma ecuación para superficies planas:
donde U es la función de paso unitario. Las definiciones de los demás símbolos son las siguientes:
donde "ads" significa "adsorbido", "m" significa "equivalencia de monocapa" y "vap" es la referencia a la presión de vapor del líquido adsorbente a la misma temperatura que la muestra sólida. La función unitaria crea la definición de la energía molar de adsorción para la primera molécula adsorbida mediante:
La gráfica de adsorbido versus se conoce como gráfica de chi. Para superficies planas, la pendiente del gráfico chi produce el área de la superficie. Empíricamente, Michael Polanyi [20] [21] [22] y también Jan Hendrik de Boer y Cornelis Zwikker [23] observaron que esta gráfica se ajustaba muy bien a la isoterma, pero no la siguieron. Esto se debió a las críticas de Albert Einstein en el primer caso y de Brunauer en el segundo. Esta ecuación de superficie plana se puede utilizar como una "curva estándar" en la tradición normal de las curvas de comparación, con la excepción de que la primera parte del gráfico de versus de la muestra porosa actúa como un autoestándar. Mediante esta técnica se pueden analizar las condiciones ultramicroporosas, microporosas y mesoporosas. Las desviaciones estándar típicas para ajustes isotérmicos completos, incluidas muestras porosas, son inferiores al 2%.
Observe que en esta descripción de la adsorción física, la entropía de la adsorción es consistente con el criterio termodinámico de Dubinin, es decir, la entropía de la adsorción del estado líquido al estado adsorbido es aproximadamente cero.

Los adsorbentes se utilizan normalmente en forma de gránulos esféricos, varillas, molduras o monolitos con un radio hidrodinámico de entre 0,25 y 5 mm. Deben tener alta resistencia a la abrasión , alta estabilidad térmica y diámetros de poro pequeños, lo que da como resultado una mayor superficie expuesta y, por tanto, una alta capacidad de adsorción. Los adsorbentes también deben tener una estructura de poros distinta que permita el transporte rápido de los vapores gaseosos. [24] La mayoría de los adsorbentes industriales se clasifican en una de tres clases:

El gel de sílice es una forma amorfa de SiO 2 químicamente inerte, no tóxica, polar y dimensionalmente estable (< 400 °C o 750 °F) . Se prepara mediante la reacción entre silicato de sodio y ácido acético, seguida de una serie de procesos de postratamiento como envejecimiento, decapado, etc. Estos métodos de postratamiento dan como resultado diversas distribuciones de tamaño de poro.
La sílice se utiliza para secar el aire de proceso (por ejemplo, oxígeno, gas natural) y para la adsorción de hidrocarburos pesados (polares) del gas natural.
Las zeolitas son aluminosilicatos cristalinos naturales o sintéticos , que tienen una red de poros repetitivos y liberan agua a alta temperatura. Las zeolitas son de naturaleza polar.
Se fabrican mediante síntesis hidrotermal de aluminosilicato de sodio u otra fuente de sílice en un autoclave seguida de intercambio iónico con ciertos cationes (Na + , Li + , Ca 2+ , K + , NH 4 + ). El diámetro del canal de las jaulas de zeolita suele oscilar entre 2 y 9 Å . Al proceso de intercambio iónico le sigue el secado de los cristales, que pueden granularse con un aglutinante para formar gránulos macroporosos.
Las zeolitas se aplican en el secado del aire de proceso, la eliminación de CO 2 del gas natural, la eliminación de CO del gas de reformado, la separación de aire, el craqueo catalítico y la síntesis y reformado catalítico.
Las zeolitas no polares (silíceas) se sintetizan a partir de fuentes de sílice sin aluminio o mediante desaluminación de zeolitas que contienen aluminio. El proceso de desaluminación se realiza tratando la zeolita con vapor a temperaturas elevadas, normalmente superiores a 500 °C (930 °F). Este tratamiento térmico a alta temperatura rompe los enlaces aluminio-oxígeno y el átomo de aluminio es expulsado de la estructura de la zeolita.
El carbón activado es un sólido amorfo muy poroso que consta de microcristalitos con una red de grafito, generalmente preparado en pequeños gránulos o en polvo. Es no polar y barato. Uno de sus principales inconvenientes es que reacciona con el oxígeno a temperaturas moderadas (más de 300 °C).

El carbón activado se puede fabricar a partir de material carbonoso, incluido el carbón (bituminoso, subbituminoso y lignito), turba, madera o cáscaras de nueces (por ejemplo, coco). El proceso de fabricación consta de dos fases, carbonización y activación. [26] [27] El proceso de carbonización incluye secar y luego calentar para separar los subproductos, incluidos los alquitranes y otros hidrocarburos de la materia prima, así como para eliminar los gases generados. El proceso se completa calentando el material a más de 400 °C (750 °F) en una atmósfera libre de oxígeno que no puede soportar la combustión. Luego, las partículas carbonizadas se "activan" exponiéndolas a un agente oxidante, generalmente vapor o dióxido de carbono a alta temperatura. Este agente quema las estructuras de bloqueo de poros creadas durante la fase de carbonización y, por lo tanto, desarrollan una estructura de red de grafito tridimensional porosa. El tamaño de los poros desarrollados durante la activación es función del tiempo que pasan en esta etapa. Tiempos de exposición más prolongados dan como resultado tamaños de poro más grandes. Los carbones de fase acuosa más populares son de base bituminosa debido a su dureza, resistencia a la abrasión, distribución del tamaño de los poros y bajo costo, pero es necesario probar su efectividad en cada aplicación para determinar el producto óptimo.
El carbón activado se utiliza para la adsorción de sustancias orgánicas [28] y adsorbatos no polares y también se suele utilizar para el tratamiento de gases residuales (y aguas residuales). Es el adsorbente más utilizado ya que la mayoría de sus propiedades químicas (por ejemplo, grupos de superficie) y físicas (por ejemplo, distribución del tamaño de los poros y área de superficie) se pueden ajustar según las necesidades. [29] Su utilidad también se deriva de su gran volumen de microporos (y a veces de mesoporos) y la gran superficie resultante. Trabajos de investigación recientes informaron que el carbón activado es un agente eficaz para adsorber especies catiónicas de metales tóxicos de sistemas multicontaminantes y también propusieron posibles mecanismos de adsorción con evidencias que lo respaldan. [30]
La adsorción de agua en las superficies es de gran importancia en ingeniería química , ciencia de materiales y catálisis . También denominada hidratación superficial, la presencia de agua adsorbida física o químicamente en las superficies de los sólidos juega un papel importante en el control de las propiedades de la interfaz, las vías de reacción química y el rendimiento catalítico en una amplia gama de sistemas. En el caso del agua adsorbida físicamente, la hidratación superficial se puede eliminar simplemente mediante secado en condiciones de temperatura y presión que permitan la vaporización total del agua. Para el agua adsorbida químicamente, la hidratación puede ser en forma de adsorción disociativa, donde las moléculas de H 2 O se disocian en -H y -OH adsorbidos en la superficie, o adsorción molecular (adsorción asociativa) donde las moléculas de agua individuales permanecen intactas [31].
El bajo costo ($200/tonelada) y la alta tasa de ciclo (2000 ×) de las zeolitas sintéticas como Linde 13X con adsorbato de agua ha despertado mucho interés académico y comercial recientemente para su uso en el almacenamiento de energía térmica (TES), específicamente de energía solar de bajo grado. y calor residual. Se han financiado varios proyectos piloto en la UE desde 2000 hasta la actualidad (2020). [ cita necesaria ] El concepto básico es almacenar energía solar térmica como energía química latente en la zeolita. Normalmente, el aire caliente y seco de los colectores solares de placa plana se hace fluir a través de un lecho de zeolita de manera que se elimine cualquier adsorbato de agua presente. El almacenamiento puede ser diurno, semanal, mensual o incluso estacional dependiendo del volumen de zeolita y del área de los paneles solares térmicos. Cuando se necesita calor durante la noche, las horas sin sol o el invierno, el aire humidificado fluye a través de la zeolita. A medida que la zeolita absorbe la humedad, el calor se libera al aire y posteriormente al espacio del edificio. Esta forma de TES, con uso específico de zeolitas, fue enseñada por primera vez por John Guerra en 1978. [32]
Los adsorbentes típicos propuestos para la captura y almacenamiento de carbono son las zeolitas y los MOF . [33] La personalización de los adsorbentes los convierte en una alternativa potencialmente atractiva a la absorción. Debido a que los adsorbentes pueden regenerarse mediante cambios de temperatura o presión, este paso puede consumir menos energía que los métodos de regeneración por absorción . [34] Los principales problemas que están presentes con el costo de adsorción en la captura de carbono son: regeneración del adsorbente, relación de masa, solvente/MOF, costo del adsorbente, producción del adsorbente, vida útil del adsorbente. [35]
En la tecnología de desplazamiento de gas de agua mejorado por sorción (SEWGS), un proceso de captura de carbono previo a la combustión, basado en la adsorción de sólidos, se combina con la reacción de desplazamiento de gas de agua (WGS) para producir una corriente de hidrógeno a alta presión. [36] El flujo de CO 2 producido puede almacenarse o utilizarse para otros procesos industriales. [37]
La adsorción de proteínas es un proceso que tiene un papel fundamental en el campo de los biomateriales . De hecho, las superficies de los biomateriales en contacto con medios biológicos, como la sangre o el suero, quedan inmediatamente recubiertas de proteínas. Por tanto, las células vivas no interactúan directamente con la superficie del biomaterial, sino con la capa de proteínas adsorbidas. Esta capa de proteína media en la interacción entre los biomateriales y las células, traduciendo las propiedades físicas y químicas del biomaterial a un "lenguaje biológico". [38] De hecho, los receptores de la membrana celular se unen a los sitios bioactivos de la capa proteica y estos eventos de unión receptor-proteína se transducen, a través de la membrana celular, de una manera que estimula procesos intracelulares específicos que luego determinan la adhesión, la forma, el crecimiento y la diferenciación celular. La adsorción de proteínas está influenciada por muchas propiedades de la superficie, como la humectabilidad de la superficie , la composición química de la superficie [39] y la morfología a escala nanométrica de la superficie. [40] La adsorción de surfactante es un fenómeno similar, pero utiliza moléculas de surfactante en lugar de proteínas. [41]
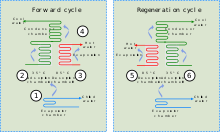
Al combinar un adsorbente con un refrigerante, los enfriadores de adsorción utilizan calor para proporcionar un efecto de enfriamiento. Este calor, en forma de agua caliente, puede provenir de diversas fuentes industriales, incluido el calor residual de procesos industriales, el calor primario de instalaciones solares térmicas o el calor de escape o de la camisa de agua de un motor de pistón o una turbina.
Aunque existen similitudes entre los enfriadores de adsorción y la refrigeración por absorción , los primeros se basan en la interacción entre gases y sólidos. La cámara de adsorción del enfriador está llena de un material sólido (por ejemplo, zeolita, gel de sílice, alúmina, carbón activo o ciertos tipos de sales metálicas), que en su estado neutro ha adsorbido el refrigerante. Cuando se calienta, el sólido desorbe (libera) el vapor del refrigerante, que posteriormente se enfría y se licúa. Este refrigerante líquido luego proporciona un efecto de enfriamiento en el evaporador debido a su entalpía de vaporización . En la etapa final, el vapor del refrigerante se (re)adsorbe en el sólido. [42] Como un enfriador de adsorción no requiere compresor, es relativamente silencioso.
La adsorción mediada por sitio portal es un modelo para la adsorción selectiva de gas activado en sistemas catalíticos metálicos que contienen una variedad de sitios de adsorción diferentes. En tales sistemas, los sitios similares a defectos de "borde y esquina" de baja coordinación pueden exhibir entalpías de adsorción significativamente más bajas que los sitios de alta coordinación ( plano basal ). Como resultado, estos sitios pueden servir como "portales" para una adsorción muy rápida al resto de la superficie. El fenómeno se basa en el efecto de "desbordamiento" común (que se describe a continuación), donde ciertas especies adsorbidas exhiben una alta movilidad en algunas superficies. El modelo explica observaciones aparentemente inconsistentes de la termodinámica y cinética de la adsorción de gases en sistemas catalíticos donde las superficies pueden existir en una variedad de estructuras de coordinación, y se ha aplicado con éxito a sistemas catalíticos bimetálicos donde se observa actividad sinérgica.
A diferencia del desbordamiento puro, la adsorción en el sitio portal se refiere a la difusión superficial a sitios de adsorción adyacentes, no a superficies de soporte no absorbentes.
El modelo parece haber sido propuesto por primera vez para monóxido de carbono sobre platino soportado en sílice por Brandt et al. (1993). [43] King y sus colaboradores desarrollaron un modelo similar, pero independiente, [44] [45] [46] para describir la adsorción de hidrógeno en catalizadores bimetálicos de rutenio, plata-rutenio y cobre-rutenio promovidos con álcalis soportados sobre sílice. El mismo grupo aplicó el modelo a la hidrogenación de CO ( síntesis de Fischer-Tropsch ). [47] Županc et al. (2002) confirmaron posteriormente el mismo modelo para la adsorción de hidrógeno en catalizadores bimetálicos de cesio-rutenio soportados por magnesia. [48] Trens et al. (2009) han descrito de manera similar la difusión superficial de CO en partículas de Pt soportadas por carbono de diferente morfología. [49]
En el caso de sistemas catalíticos o adsorbentes en los que una especie metálica se dispersa sobre un material de soporte (o portador) (a menudo óxidos casi inertes, como alúmina o sílice), es posible que una especie adsorbente se adsorba indirectamente en la superficie de soporte bajo condiciones en las que dicha adsorción es termodinámicamente desfavorable. La presencia del metal sirve como una vía de menor energía para que las especies gaseosas se adsorban primero en el metal y luego se difundan en la superficie del soporte. Esto es posible porque las especies adsorbidas alcanzan un estado de energía más bajo una vez que se han adsorbido en el metal, reduciendo así la barrera de activación entre las especies en fase gaseosa y las especies adsorbidas en el soporte.
El desbordamiento de hidrógeno es el ejemplo más común de desbordamiento por adsorción. En el caso del hidrógeno, la adsorción suele ir acompañada de la disociación del hidrógeno molecular (H 2 ) en hidrógeno atómico (H), seguida del desbordamiento de los átomos de hidrógeno presentes.
El efecto derrame se ha utilizado para explicar muchas observaciones en catálisis y adsorción heterogéneas . [50]
La adsorción de moléculas sobre superficies poliméricas es fundamental para varias aplicaciones, incluido el desarrollo de recubrimientos antiadherentes y en diversos dispositivos biomédicos. Los polímeros también pueden adsorberse en superficies mediante adsorción de polielectrolitos .
La adsorción es el primer paso en el ciclo de vida viral . Los siguientes pasos son la penetración, el descubierto, la síntesis (transcripción si es necesario y traducción) y liberación. El ciclo de replicación del virus, a este respecto, es similar para todos los tipos de virus. Factores como la transcripción pueden ser necesarios o no si el virus es capaz de integrar su información genómica en el núcleo de la célula, o si el virus puede replicarse directamente dentro del citoplasma de la célula.
El juego de Tetris es un juego de rompecabezas en el que bloques de 4 se adsorben en una superficie durante el juego. Los científicos han utilizado los bloques de Tetris "como sustitutos de moléculas de forma compleja" y su "adsorción en una superficie plana" para estudiar la termodinámica de las nanopartículas . [51] [52]
{{cite book}}: CS1 maint: location missing publisher (link)[ página necesaria ]