Las células de Sertoli son un tipo de célula sustentacular "nodriza" que se encuentra en los testículos humanos y que contribuyen al proceso de espermatogénesis (la producción de espermatozoides ) como componente estructural de los túbulos seminíferos . Son activados por la hormona folículo estimulante (FSH) secretada por la adenohipófisis y expresan el receptor de FSH en sus membranas.
Las células de Sertoli llevan el nombre de Enrico Sertoli , un fisiólogo italiano que las descubrió mientras estudiaba medicina en la Universidad de Pavía , Italia. [1] Publicó una descripción de su célula homónima en 1865. [2] La célula fue descubierta por Sertoli con un microscopio Belthle que había comprado en 1862. En la publicación de 1865, su primera descripción utilizó los términos "célula en forma de árbol". " o "célula fibrosa"; lo más importante es que se refirió a ellas como "células madre". Posteriormente, otros científicos utilizaron el apellido de Enrico para etiquetar estas células en publicaciones, a partir de 1888. En 2006, se publicaron dos libros de texto dedicados específicamente a la célula de Sertoli.
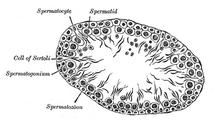
Las células de Sertoli se ubican específicamente en las circunvoluciones de los túbulos seminíferos, ya que este es el único lugar de los testículos donde se producen los espermatozoides. Como célula de soporte principal de los túbulos, generalmente son muy grandes y amorfas, con células individuales que se extienden desde la lámina basal hasta la luz; su citoplasma a menudo rodea completamente las células de la línea germinal que son responsables de cuidar. Las células de Sertoli se confunden fácilmente con otras células del epitelio germinal cuando se utilizan técnicas de tinción estándar; el rasgo más distintivo de la célula de Sertoli es su nucléolo oscuro . [3]
Las células de Sertoli son necesarias para el desarrollo sexual masculino. La proliferación y diferenciación de las células de Sertoli es activada principalmente por FGF9 , con el que también forman un bucle de alimentación. [4] [5] Se ha sugerido que las células de Sertoli pueden derivar del mesonefros fetal . [6] Después de la pubertad, las células de Sertoli comienzan a alargarse. Sus nucléolos se agrandan y se completan las uniones estrechas, creando un espacio luminal lleno de líquido. [7]
La FSH es responsable de controlar la proliferación de las células de Sertoli poco después del nacimiento y estimula la producción de factores derivados de las células de Sertoli que controlan el desarrollo de los testículos y las células germinales. FSH, hormona luteinizante . Se sabe que la hormona estimulante de la tiroides y la hCG afectan el desarrollo de las células de Sertoli y la salud reproductiva masculina. La FSH es necesaria para el mitógeno de las células de Sertoli, que estimula la expresión de varios marcadores celulares. [7]
Una vez completamente diferenciada, la célula de Sertoli se considera terminalmente diferenciada y no puede proliferar. [8] Por lo tanto, una vez que ha comenzado la espermatogénesis, no se crean más células de Sertoli y su población dentro de los túbulos seminíferos es finita.
Sin embargo, recientemente los científicos han encontrado una manera de inducir las células de Sertoli a un fenotipo proliferativo juvenil fuera del cuerpo. [9] Esto da lugar a la posibilidad de reparar algunos defectos de las células del nicho testicular que pueden causar infertilidad masculina.
Debido a que su función principal es nutrir los espermatozoides en desarrollo a través de las etapas de la espermatogénesis , la célula de Sertoli también ha sido llamada célula "madre" o "nodriza". [10] Las células de Sertoli también actúan como fagocitos , consumiendo el citoplasma residual durante la espermatogénesis. La translocación de células desde la lámina basal a la luz de los túbulos seminíferos se produce por cambios conformacionales en los márgenes laterales de las células de Sertoli.
Las células de Sertoli secretan las siguientes sustancias:
Las uniones oclusivas de las células de Sertoli forman la barrera hematotesticular , una estructura que separa el compartimento sanguíneo intersticial del testículo del compartimento adluminal de los túbulos seminíferos. Debido a la progresión apical de las espermatogonias , las uniones oclusivas deben reformarse y romperse dinámicamente para permitir que las espermatogonias inmunoidénticas crucen la barrera hematotesticular para que puedan volverse inmunológicamente únicas. Las células de Sertoli controlan la entrada y salida de nutrientes , hormonas y otras sustancias químicas en los túbulos de los testículos, además de hacer del compartimento adluminal un sitio inmune privilegiado.
Las células de Sertoli también son responsables de establecer y mantener el nicho de células madre espermatogoniales , lo que asegura la renovación de las células madre y la diferenciación de las espermatogonias en células germinales maduras que progresan paso a paso a través del largo proceso de espermatogénesis, finalizando con la liberación de espermatozoides en un proceso. conocido como espermiación . [13] Las células de Sertoli se unen a las células espermatogoniales a través de N-cadherinas y galactosiltransferasa (a través de residuos de carbohidratos).
Durante la espermatogénesis, las células de Sertoli aportan nutrición a las espermatogonias.
Las células de Sertoli son capaces de reparar el daño del ADN . [14] Esta reparación probablemente emplea el proceso de unión de extremos no homólogos que involucra a las proteínas XRCC1 y PARP1 que se expresan en las células de Sertoli. [14]
Las células de Sertoli tienen una frecuencia de mutación mayor que las células espermatogénicas . [15] En comparación con los espermatocitos , la frecuencia de mutación es aproximadamente de 5 a 10 veces mayor en las células de Sertoli. Esto puede reflejar la necesidad de una mayor eficiencia en la reparación del ADN y la evitación de mutaciones en la línea germinal que en las células somáticas.
Además de expresar factores que son cruciales para la maduración de los espermatozoides, las células de Sertoli también producen una amplia gama de moléculas (ya sea en su superficie o solubles) que pueden modificar el sistema inmunológico. La capacidad de las células de Sertoli para cambiar la respuesta inmune en el túbulo es necesaria para una maduración exitosa de los espermatozoides. Los espermatozoides expresan neoepítopos en su superficie a medida que avanzan a través de diferentes etapas de maduración, lo que puede desencadenar una fuerte respuesta inmune si se colocan en una parte diferente del cuerpo.
Sistema FAS/FAS-L: la expresión del ligando de Fas (Fas-L) en la superficie de las SC activa la muerte apoptótica de las células portadoras del receptor de Fas, por ejemplo, las células T citotóxicas . [dieciséis]
- FasL soluble: aumentando la efectividad del sistema
- Fas soluble: bloqueo de FasL en la superficie de otras células (sin inducción apoptótica en las células de Sertoli por parte de las células inmunes)
B7/H1: disminución de la proliferación de células T efectoras [17]
Jagged1 (JAG1): inducción de la expresión del factor de transcripción Foxp3 en linfocitos T vírgenes (números relativos crecientes de células T reguladoras ) [18]
Inhibidor de proteasa-9 (PI-9): miembro de la familia de las serpinas (inhibidores de serina proteasa), [19] que induce la secreción de proteasa granzima B , las células T citotóxicas y las células NK pueden inducir la apoptosis en la célula diana. Las SC producen PI-9 que une irreversiblemente la Granzima B e inhibe su actividad.
CD59 , una molécula de superficie en las SC y miembro de las proteínas reguladoras del complemento (PCR), inhibe el último paso de la cascada del complemento , la formación del complejo de ataque a la membrana . [20]
La clusterina, una molécula soluble con funciones similares a CD59, forma un complejo con la granzima B e inhibe la activación de la apoptosis por parte de los linfocitos T o las células NK. [20]
El TGF -beta, un factor de crecimiento transformante beta (su producción directa por las SC es controvertida), contribuye a la inducción de células T reguladoras en la periferia. [21]
CD40 , una molécula asociada a las células dendríticas (CD). Las SC pueden regular negativamente la expresión de CD40 en la superficie de las CD, mediante un mecanismo desconocido. La regulación negativa de CD40 da como resultado una capacidad disminuida de las CD para estimular la respuesta de las células T. [20]
Las células de Sertoli también pueden inhibir la migración de las células inmunitarias al reducir la infiltración de células inmunitarias en el sitio de la inflamación.
El tumor de células de Sertoli-Leydig forma parte del grupo de neoplasias de ovario de tumores del estroma del cordón sexual . Estos tumores producen células de Sertoli y Leydig y provocan un aumento de la secreción de testosterona en los ovarios y los testículos.
La función de las células de Sertoli en Amniota y Anamniota es la misma, pero tienen propiedades ligeramente diferentes en comparación entre sí. Los anamniontes (peces y anfibios) emplean la espermatogénesis quística para producir espermatozoides. [22] En Amniota, las células de Sertoli son células terminalmente diferenciadas que normalmente son incapaces de proliferar. En Anamniota, las células de Sertoli pasan por dos fases proliferativas. La primera fase de proliferación ocurre durante el establecimiento del quiste, promoviendo la migración de células germinales hacia él. [23] [24] La segunda fase implica el agrandamiento del quiste que produce espacio para las células germinales en proliferación. [25]
Recientemente se ha cuestionado el hecho, alguna vez comúnmente aceptado, de que las células de Sertoli son incapaces de dividirse y proliferar en Amniota. Tras el trasplante xenogénico, se ha demostrado que las células de Sertoli recuperan la capacidad de proliferar. [26]
Recientemente (2016), modelos experimentales de trastornos inflamatorios autoinmunes , incluida la diabetes , han impulsado la implicación de las células de Sertoli en el trasplante de terapia celular gracias a sus propiedades inmunorreguladoras y antiinflamatorias. [27]
La investigación sobre la adaptación de las células de Sertoli para su uso en el tratamiento de la diabetes mellitus tipo I implica la estrategia de cotrasplantar células β junto con células de Sertoli en el organismo receptor. En ratones, ratas y humanos, la presencia de estas células restableció la homeostasis de la glucosa y redujo las necesidades de insulina externa . En todos los casos no se utilizó inmunosupresión y el papel de esta medicación fue asumido y proporcionado por SC. [28] [29] [30]
Al tratar ratones espontáneamente diabéticos y obesos con el trasplante de células de Sertoli microencapsuladas en depósitos de grasa abdominal subcutánea, Giovanni et al. [27] demostraron que más de la mitad de los ratones tratados mostraron una mejor homeostasis de la glucosa. Este reciente trabajo científico promete un futuro mejor tratamiento a los pacientes con diabetes mellitus tipo 2 mediante el uso de terapia celular.
Las células de Sertoli promueven la aceptación del injerto de piel por parte del organismo receptor [31] y su presencia también ayuda a aumentar el número de neuronas motoras en la médula espinal de ratones SOD1 (un modelo de ratón utilizado en el estudio de la esclerosis lateral amiotrófica ). [32]