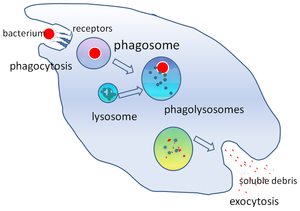
En biología celular , un fagosoma es una vesícula formada alrededor de una partícula engullida por un fagocito mediante fagocitosis . Los fagocitos profesionales incluyen macrófagos , neutrófilos y células dendríticas (CD). [1]
Un fagosoma se forma por la fusión de la membrana celular alrededor de un microorganismo , una célula senescente o una célula apoptótica . Los fagosomas tienen proteínas unidas a la membrana para reclutar y fusionarse con lisosomas para formar fagolisosomas maduros . Los lisosomas contienen enzimas hidrolíticas y especies reactivas de oxígeno (ROS) que matan y digieren los patógenos . Los fagosomas también pueden formarse en fagocitos no profesionales, pero solo pueden engullir una gama más pequeña de partículas y no contienen ROS. Los materiales útiles (por ejemplo, aminoácidos ) de las partículas digeridas se mueven al citosol y los desechos se eliminan por exocitosis . La formación de fagosomas es crucial para la homeostasis tisular y la defensa innata y adaptativa del huésped contra los patógenos.
Sin embargo, algunas bacterias pueden explotar la fagocitosis como una estrategia de invasión. Se reproducen dentro del fagolisosoma ( p. ej. , Coxiella spp.) [2] o escapan al citoplasma antes de que el fagosoma se fusione con el lisosoma (p. ej., Rickettsia spp.). [3] Muchas micobacterias, incluidas Mycobacterium tuberculosis [4] [5] y Mycobacterium avium paratuberculosis [6], pueden manipular el macrófago huésped para evitar que los lisosomas se fusionen con los fagosomas y creen fagolisosomas maduros. Esta maduración incompleta del fagosoma mantiene un entorno favorable para los patógenos en su interior. [7]
Los fagosomas son lo suficientemente grandes como para degradar bacterias enteras o células apoptóticas y senescentes, que suelen tener un diámetro de >0,5 μm. [8] Esto significa que un fagosoma es varios órdenes de magnitud más grande que un endosoma , que se mide en nanómetros .
Los fagosomas se forman cuando los patógenos o las opsoninas se unen a un receptor transmembrana, que se distribuyen aleatoriamente en la superficie celular del fagocito. Tras la unión, la señalización "de afuera hacia adentro" desencadena la polimerización de actina y la formación de pseudópodos , que rodean y se fusionan detrás del microorganismo. La proteína quinasa C , la fosfoinosítido 3-quinasa y la fosfolipasa C (PLC) son necesarias para la señalización y el control de la internalización de partículas. [9] Más receptores de la superficie celular pueden unirse a la partícula en un mecanismo similar a una cremallera a medida que el patógeno está rodeado, lo que aumenta la avidez de unión . [10] El receptor Fc (FcR), los receptores del complemento (CR), el receptor de manosa y la dectina-1 son receptores fagocíticos, lo que significa que pueden inducir la fagocitosis si se expresan en células no fagocíticas, como los fibroblastos . [11] Otras proteínas, como los receptores tipo Toll , participan en el reconocimiento de patrones de patógenos y a menudo son reclutadas por los fagosomas, pero no desencadenan específicamente la fagocitosis en células no fagocíticas, por lo que no se consideran receptores fagocíticos.
Las opsoninas son marcadores moleculares, como los anticuerpos y los complementos , que se adhieren a los patógenos y regulan positivamente la fagocitosis. La inmunoglobulina G (IgG) es el principal tipo de anticuerpo presente en el suero . Forma parte del sistema inmunitario adaptativo , pero se vincula con la respuesta innata al reclutar macrófagos para fagocitar a los patógenos. El anticuerpo se une a los microbios con el dominio variable Fab , y el dominio Fc se une a los receptores Fc (FcR) para inducir la fagocitosis.
La internalización mediada por complemento tiene protrusiones de membrana mucho menos significativas, pero la señalización descendente de ambas vías converge para activar las GTPasas Rho . [12] Controlan la polimerización de actina, que es necesaria para que el fagosoma se fusione con los endosomas y los lisosomas.
Otros fagocitos no profesionales tienen cierto grado de actividad fagocítica, como las células epiteliales de la tiroides y la vejiga que pueden engullir eritrocitos y las células epiteliales de la retina que internalizan los bastones de la retina. [8] Sin embargo, los fagocitos no profesionales no expresan receptores fagocíticos específicos como FcR y tienen una tasa de internalización mucho menor.
Algunas bacterias invasoras también pueden inducir la fagocitosis en células no fagocíticas para mediar la absorción por parte del huésped. Por ejemplo, Shigella puede secretar toxinas que alteran el citoesqueleto del huésped y penetran en el lado basolateral de los enterocitos . [13]
Como la membrana del fagosoma se forma por la fusión de la membrana plasmática, la composición básica de la bicapa de fosfolípidos es la misma. Los endosomas y lisosomas se fusionan luego con el fagosoma para contribuir a la membrana, especialmente cuando la partícula engullida es muy grande, como un parásito . [14] También entregan varias proteínas de membrana al fagosoma y modifican la estructura del orgánulo.
Los fagosomas pueden engullir perlas artificiales de látex de baja densidad y luego purificarlas a lo largo de un gradiente de concentración de sacarosa , lo que permite estudiar la estructura y la composición. [15] Al purificar los fagosomas en diferentes puntos temporales, también se puede caracterizar el proceso de maduración. Los fagosomas tempranos se caracterizan por Rab5, que se transforma en Rab7 a medida que la vesícula madura y se convierte en fagosomas tardíos.
El fagosoma naciente no es inherentemente bactericida. A medida que madura, se vuelve más ácido de pH 6,5 a pH 4, y obtiene marcadores proteicos característicos y enzimas hidrolíticas. Las diferentes enzimas funcionan a varios pH óptimos, formando un rango para que cada una trabaje en etapas estrechas del proceso de maduración. La actividad enzimática se puede ajustar modificando el nivel de pH, lo que permite una mayor flexibilidad. El fagosoma se mueve a lo largo de los microtúbulos del citoesqueleto , fusionándose con endosomas y lisosomas secuencialmente en una manera dinámica de "beso y fuga" . [16] Este transporte intracelular depende del tamaño de los fagosomas. Los orgánulos más grandes (con un diámetro de aproximadamente 3 μm) se transportan de manera muy persistente desde la periferia celular hacia la región perinuclear, mientras que los orgánulos más pequeños (con un diámetro de aproximadamente 1 μm) se transportan de manera más bidireccional de ida y vuelta entre el centro celular y la periferia celular. [17] Las bombas de protones vacuolares (v-ATPasa) se envían al fagosoma para acidificar el compartimento del orgánulo, lo que crea un entorno más hostil para los patógenos y facilita la degradación de las proteínas. Las proteínas bacterianas se desnaturalizan en un pH bajo y se vuelven más accesibles a las proteasas, que no se ven afectadas por el entorno ácido. Las enzimas se reciclan posteriormente desde el fagolisosoma antes de la egestión para que no se desperdicien. La composición de la membrana de fosfolípidos también cambia a medida que el fagosoma madura. [15]
La fusión puede tardar minutos u horas dependiendo del contenido del fagosoma; la fusión mediada por el receptor de manosa o FcR dura menos de 30 minutos, pero los fagosomas que contienen perlas de látex pueden tardar varias horas en fusionarse con los lisosomas. [8] Se sugiere que la composición de la membrana del fagosoma afecta la tasa de maduración. Mycobacterium tuberculosis tiene una pared celular muy hidrófoba , que se plantea la hipótesis de que impide el reciclaje de la membrana y el reclutamiento de factores de fusión, por lo que el fagosoma no se fusiona con los lisosomas y la bacteria evita la degradación. [18]
Las moléculas luminales más pequeñas se transfieren por fusión más rápidamente que las moléculas más grandes, lo que sugiere que se forma un pequeño canal acuoso entre el fagosoma y otras vesículas durante el "beso y fuga", a través del cual solo se permite un intercambio limitado. [8]
Poco después de la internalización, la F-actina se despolimeriza del fagosoma recién formado, de modo que se vuelve accesible a los endosomas para la fusión y el suministro de proteínas. [8] El proceso de maduración se divide en etapas tempranas y tardías según los marcadores proteicos característicos, regulados por pequeñas GTPasas Rab. Rab5 está presente en los fagosomas tempranos y controla la transición a los fagosomas tardíos marcados por Rab7. [19]
Rab5 recluta a la quinasa PI-3 y otras proteínas de anclaje como Vps34 a la membrana del fagosoma, de modo que los endosomas puedan entregar proteínas al fagosoma. Rab5 está parcialmente involucrado en la transición a Rab7, a través del complejo CORVET y el complejo HOPS en levadura. [19] La vía de maduración exacta en mamíferos no se entiende bien, pero se sugiere que HOPS puede unirse a Rab7 y desplazar al inhibidor de disociación de nucleótidos de guanosina (GDI). [20] Rab11 está involucrado en el reciclaje de membrana. [21]
El fagosoma se fusiona con los lisosomas para formar un fagolisosoma, que tiene varias propiedades bactericidas. El fagolisosoma contiene especies reactivas de oxígeno y nitrógeno (ROS y RNS) y enzimas hidrolíticas. El compartimento también es ácido debido a las bombas de protones (v-ATPasas) que transportan H + a través de la membrana, utilizadas para desnaturalizar las proteínas bacterianas.
Las propiedades exactas de los fagolisosomas varían según el tipo de fagocito. Los de las células dendríticas tienen propiedades bactericidas más débiles que los de los macrófagos y los neutrófilos. Además, los macrófagos se dividen en M1 "asesinos" proinflamatorios y M2 "reparadores". Los fagolisosomas de M1 pueden metabolizar la arginina en óxido nítrico altamente reactivo , mientras que M2 utiliza la arginina para producir ornitina para promover la proliferación celular y la reparación de tejidos. [22]
Los macrófagos y los neutrófilos son fagocitos profesionales encargados de la mayor parte de la degradación de patógenos, pero tienen diferentes métodos bactericidas. Los neutrófilos tienen gránulos que se fusionan con el fagosoma. Los gránulos contienen NADPH oxidasa y mieloperoxidasa , que producen derivados tóxicos de oxígeno y cloro para matar patógenos en un estallido oxidativo . Las proteasas y los péptidos antimicrobianos también se liberan en el fagolisosoma. Los macrófagos carecen de gránulos y dependen más de la acidificación del fagolisosoma, las glicosidasas y las proteasas para digerir los microbios. [21] Los fagosomas en las células dendríticas son menos ácidos y tienen una actividad hidrolítica mucho más débil, debido a una menor concentración de proteasas lisosomales e incluso a la presencia de inhibidores de proteasas.
La formación de fagosomas está vinculada a la inflamación a través de moléculas de señalización comunes. La PI-3 quinasa y la PLC están involucradas tanto en el mecanismo de internalización como en el desencadenamiento de la inflamación. [9] Las dos proteínas, junto con las Rho GTPasas, son componentes importantes de la respuesta inmune innata, que inducen la producción de citocinas y activan la cascada de señalización de la MAP quinasa . Se producen citocinas proinflamatorias, incluidas IL-1β , IL-6 , TNFα e IL-12 . [8]
El proceso está estrechamente regulado y la respuesta inflamatoria varía según el tipo de partícula dentro del fagosoma. Las células apoptóticas infectadas por patógenos desencadenan la inflamación, pero las células dañadas que se degradan como parte del recambio tisular normal no lo hacen. La respuesta también difiere según la fagocitosis mediada por opsonina. Las reacciones mediadas por el receptor FcR y el receptor de manosa producen especies reactivas de oxígeno proinflamatorias y moléculas de ácido araquidónico , pero las reacciones mediadas por el CR no dan lugar a esos productos. [8]
Las células dendríticas inmaduras (CD) pueden fagocitar, pero las CD maduras no pueden debido a cambios en las GTPasas Rho involucradas en la remodelación del citoesqueleto. [21] Los fagosomas de las CD son menos hidrolíticos y ácidos que los de los macrófagos y neutrófilos, ya que las CD están principalmente involucradas en la presentación de antígenos en lugar de la degradación de patógenos. Necesitan retener fragmentos de proteína de un tamaño adecuado para el reconocimiento bacteriano específico, por lo que los péptidos solo se degradan parcialmente. [21] Los péptidos de las bacterias se transportan al complejo mayor de histocompatibilidad (CMH). Los antígenos peptídicos se presentan a los linfocitos , donde se unen a los receptores de células T y activan las células T , cerrando la brecha entre la inmunidad innata y adaptativa. [9] Esto es específico de los mamíferos , las aves y los peces con mandíbula, ya que los insectos no tienen inmunidad adaptativa. [23]

Los organismos unicelulares antiguos como la ameba utilizan la fagocitosis como una forma de adquirir nutrientes, en lugar de una estrategia inmunológica. Engullen a otros microbios más pequeños y los digieren dentro del fagosoma de alrededor de una bacteria por minuto, lo que es mucho más rápido que los fagocitos profesionales. [24] Para la ameba del suelo Dictyostelium discoideum , su principal fuente de alimento es la bacteria Legionella pneumophila , que causa la enfermedad del legionario en humanos. [25] La maduración del fagosoma en la ameba es muy similar a la de los macrófagos, por lo que se utilizan como organismo modelo para estudiar el proceso. [16]
Los fagosomas degradan las células senescentes y las células apoptóticas para mantener la homeostasis tisular. Los eritrocitos tienen una de las tasas de recambio más altas del cuerpo y son fagocitados por los macrófagos en el hígado y el bazo . En el embrión , el proceso de eliminación de células muertas no está bien caracterizado, pero no lo realizan los macrófagos ni otras células derivadas de las células madre hematopoyéticas . [26] Solo en el adulto las células apoptóticas son fagocitadas por fagocitos profesionales. La inflamación solo se desencadena por ciertos patrones moleculares asociados a patógenos o daños (PAMP o DAMP), la eliminación de células senescentes no es inflamatoria. [14]
Los autofagosomas se diferencian de los fagosomas en que se utilizan principalmente para degradar selectivamente orgánulos citosólicos dañados, como las mitocondrias ( mitofagia ). Sin embargo, cuando la célula está hambrienta o estresada, los autofagosomas también pueden degradar de forma no selectiva los orgánulos para proporcionar a la célula aminoácidos y otros nutrientes. [27] La autofagia no se limita a los fagocitos profesionales, fue descubierta por primera vez en los hepatocitos de rata por el biólogo celular Christian de Duve . [28] Los autofagosomas tienen una membrana doble, la interna del orgánulo engullido, y se especula que la membrana externa se forma a partir del retículo endoplásmico o el Compartimento Intermedio ER-Golgi (ERGIC). [29] El autofagosoma también se fusiona con los lisosomas para degradar su contenido. Cuando M. tuberculosis inhibe la acidificación del fagosoma, el interferón gamma puede inducir la autofagia y rescatar el proceso de maduración. [30]
Muchas bacterias han evolucionado para evadir las propiedades bactericidas de los fagosomas o incluso explotar la fagocitosis como estrategia de invasión.