Transandinomys talamancae es un roedor de la familia Cricetidae que se encuentra desde Costa Rica hasta el suroeste de Ecuador y el norte de Venezuela . Su hábitat consiste en bosques de tierras bajas hasta 1.500 m (5.000 pies) sobre el nivel del mar . Con una masa corporal de 38 a 74 g (1,3 a 2,6 oz), es una rata arrocera de tamaño mediano . El pelaje es suave y es de color rojizo a marrón en las partes superiores y blanco a beige en las partes inferiores . La cola es marrón oscuro por encima y más clara por debajo y las orejas y los pies son largos. Las vibrisas (bigotes) son muy largas. En el cráneo, el rostro (parte delantera) es largo y la caja craneana es baja. El número de cromosomas varía de 34 a 54.
La especie fue descrita por primera vez en 1891 por Joel Asaph Allen y posteriormente se aplicaron una variedad de nombres, ahora considerados sinónimos , a las poblaciones locales. Se agrupó en una especie ampliamente distribuida " Oryzomys capito " (ahora Hylaeamys megacephalus ) desde la década de 1960 hasta la de 1980 y la asignación actual de sinónimos data de 1998. Se colocó en el género Oryzomys hasta 2006, como Oryzomys talamancae , pero no está estrechamente relacionado con la especie tipo de ese género y, por lo tanto, se trasladó a un género separado Transandinomys en 2006. Comparte este género con Transandinomys bolivaris , que tiene vibrisas aún más largas; los dos se superponen ampliamente en distribución y son morfológicamente similares.
Activa durante la noche, Transandinomys talamancae vive en el suelo y se alimenta de plantas e insectos. Los machos se desplazan más y tienen áreas de distribución más amplias que la mayoría de las hembras. Se reproduce durante todo el año, aunque pocos individuos sobreviven más de un año. Después de un período de gestación de unos 28 días, nacen de dos a cinco crías, que alcanzan la madurez sexual en dos meses. Esta especie presenta una variedad de parásitos . Es una especie muy extendida y común, por lo que no presenta problemas de conservación.
En 1891, Joel Asaph Allen fue el primero en describir científicamente a Transandinomys talamancae , cuando nombró a Oryzomys talamancae a partir de un espécimen de Talamanca, Costa Rica. Lo colocó en el género Oryzomys , entonces definido de manera más amplia que ahora, y lo comparó tanto con la rata arrocera de pantano ( O. palustris ) como con O. laticeps . [14] Varios otros nombres que ahora se reconocen como sinónimos de Transandinomys talamancae se introdujeron en los años siguientes. En 1899, Allen describió a Oryzomys mollipilosus , O. magdalenae y O. villosus del departamento de Magdalena , Colombia. [15] Oldfield Thomas agregó O. sylvaticus de Santa Rosa , Ecuador en 1900 [16] y O. panamensis de Ciudad de Panamá , Panamá, en 1901. [17] En el mismo año, Wirt Robinson y Markus Lyon nombraron a Oryzomys medius de cerca de La Guaira , Venezuela. [18] Allen agregó O. carrikeri de Talamanca, Costa Rica, en 1908. [19]
Edward Alphonso Goldman revisó la lista de Oryzomys de América del Norte en 1918. Colocó tanto panamensis como carrikeri como sinónimos de Oryzomys talamancae y mencionó a O. mollipilosus y O. medius como especies estrechamente relacionadas. O. talamancae era el único miembro de su propio grupo de especies, que Goldman consideraba más cercano a Oryzomys bombycinus (= Transandinomys bolivaris ). [20] En 1960, Philip Hershkovitz incluyó a talamancae , medius , magdalenae , sylvaticus y mollipilosus entre los muchos sinónimos de " Oryzomys laticeps ", un nombre posteriormente reemplazado por " Oryzomys capito ". [21] La especie permaneció agrupada bajo Oryzomys capito hasta 1983, cuando Alfred Gardner la volvió a incluir como especie válida, una acción documentada más completamente por Guy Musser y Marina Williams en 1985. [22] Musser y Williams también encontraron que el holotipo de Oryzomys villosus , cuyas afinidades habían sido disputadas, de hecho consistía en una piel de O. talamancae y un cráneo del grupo Oryzomys albigularis (equivalente al género actual Nephelomys ). Restringieron el nombre a la piel, haciendo de villosus un sinónimo de O. talamancae . [23] También examinaron los holotipos de panamensis , carrikeri , mollipilosus , medius y magdalenae y los identificaron como ejemplos de Oryzomys talamancae . Además, incluyeron a sylvaticus y Oryzomys castaneus JA Allen, 1901, de Ecuador como sinónimos, pero sin examinar los holotipos. [24] Musser y colegas revisaron el grupo nuevamente en 1998 y confirmaron que sylvaticus representa a Oryzomys talamancae ; sin embargo, encontraron que castaneus era de hecho un ejemplo de Oryzomys bolivaris (el actual Transandinomys bolivaris ). [25]
En 2006, Marcelo Weksler publicó un análisis filogenético de Oryzomyini ("ratas del arroz"), la tribu a la que se asigna Oryzomys , utilizando datos morfológicos y secuencias de ADN del gen IRBP . Sus resultados mostraron especies de Oryzomys dispersas en Oryzomyini y sugirieron que la mayoría de las especies del género deberían asignarse a nuevos géneros. [26] Oryzomys talamancae también fue incluido; apareció dentro del " clado B ", junto con otras especies anteriormente asociadas con Oryzomys capito . Algunos análisis lo colocaron más cerca de las especies ahora ubicadas en Euryoryzomys o Nephelomys , pero con poco apoyo. [27] Más tarde en el mismo año, él, junto con Alexandre Percequillo y Robert Voss, nombró diez nuevos géneros para especies previamente ubicadas en Oryzomys , incluyendo Transandinomys , que tiene a Oryzomys talamancae (ahora Transandinomys talamancae ) como su especie tipo . [12] También incluyeron a Oryzomys bolivaris , que no fue incluido en el estudio filogenético de Weksler, en este nuevo género. Las dos especies son morfológicamente similares, pero Weksler y sus colegas pudieron identificar solo una sinapomorfía (rasgo derivado compartido) para ellas: vibrisas superciliares muy largas ( vibrisas , o bigotes, sobre los ojos). [28] Transandinomys es uno de los 30 géneros de Oryzomyini, un conjunto diverso de roedores americanos de más de cien especies, [29] y en niveles taxonómicos superiores de la subfamilia Sigmodontinae de la familia Cricetidae , junto con cientos de otras especies de roedores principalmente pequeños. [30]
Se han propuesto varios nombres comunes para Transandinomys talamancae , incluidos "rata arrocera de Talamanca", [31] "Oryzomys transandino", [32] y "rata arrocera de Talamanca". [2]
Transandinomys talamancae es una rata arrocera de tamaño mediano y colores brillantes. [33] Es similar a T. bolivaris y a menudo se confunden las dos. [34] Son casi tan grandes, pero en T. talamancae la cola es más larga y las patas traseras más cortas. [35] Ambas especies comparten vibrisas excepcionalmente largas, con las vibrisas mistaciales (encima de la boca) y superciliares extendiéndose hasta o más allá del margen posterior de las orejas cuando se colocan hacia atrás contra la cabeza, pero las de T. bolivaris son sustancialmente más largas. [12] H. alfaroi , una especie muy extendida que se extiende desde México hasta Ecuador, también es similar. [36] Es más pequeña y más oscura, pero las T. talamancae adultas jóvenes son similares en color a las H. alfaroi adultas y a menudo se las identifica erróneamente. [37] Hylaeamys megacephalus , [Nota 1] con el que T. talamancae fue sinónimo durante algunas décadas, es similar en tamaño corporal, pero no se sabe que se superponga con T. talamancae en su distribución. [39]
El pelaje es corto, denso y suave en Transandinomys talamancae ; [40] en T. bolivaris , es más largo y aún más suave y denso. [41] El color de las partes superiores varía de rojizo a parduzco, volviéndose más claro hacia los lados y las mejillas. [31] Las partes inferiores son de color blanco a beige, con las bases de los pelos plomizos (de color plomo). [31] El pelaje de T. bolivaris es más oscuro: marrón oscuro por encima y gris oscuro por debajo. [42] H. megacephalus también tiene pelaje más oscuro. [43] Los juveniles tienen pelaje fino y gris, que se muda al pelaje subadulto marrón oscuro cuando el animal tiene alrededor de 35 a 40 días de edad. Este pelaje es reemplazado por el pelaje adulto brillante a la edad de 49 a 56 días. [44] Los juveniles nunca son negruzcos como en T. bolivaris . [42] Las orejas son de color marrón oscuro, [40] grandes y densamente cubiertas de pelos muy pequeños. [45]
La cola escasamente peluda es aproximadamente tan larga como la cabeza y el cuerpo. [45] Es de color marrón oscuro por encima y más clara por debajo. [40] En contraste, la cola de H. megacephalus tiene poca o ninguna diferencia de color entre la superficie superior e inferior. [43] En 2006, Weksler y colegas notaron la coloración de la cola como una diferencia entre las dos especies de Transandinomys (bicolor en T. talamancae y unicolor en T. bolivaris ), [12] pero en su estudio de 1998, Musser y colegas no pudieron encontrar diferencias en la coloración de la cola entre sus muestras panameñas de las dos especies. [47]
Las patas traseras son largas y tienen los tres dígitos centrales más largos que los dos exteriores. [47] Son de color blanco a amarillo pálido en la parte superior, [40] donde el pie está cubierto de pelos, que son más largos que en T. bolivaris . [48] Los dígitos de las patas traseras están rodeados por mechones ungueales de pelo plateado que son más largos que las propias garras. [49] Las garras son cortas y afiladas. [50] Partes de la suela están cubiertas por escamas indistintas ( escamas ), que suelen estar completamente ausentes en T. bolivaris . [51] Las almohadillas son moderadamente grandes. [47]
La longitud de la cabeza y el cuerpo es de 105 a 151 mm (4,1 a 5,9 pulgadas), la longitud de la cola de 105 a 152 mm (4,1 a 6,0 pulgadas), la longitud de las patas traseras de 26 a 32 mm (1,0 a 1,3 pulgadas), la longitud de las orejas de 17 a 24 mm (0,67 a 0,94 pulgadas) y la masa corporal de 38 a 74 g (1,3 a 2,6 oz). [52] Como en la mayoría de los orizomíneos, las hembras tienen ocho mamas . [53] Hay 12 vértebras torácicas con costillas asociadas, 7 lumbares y 29 caudales ; ocasionalmente está presente un par de costillas supernumerarias (adicionales). [54]
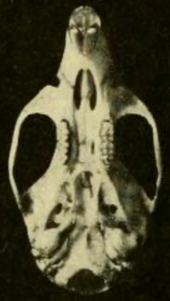
El cráneo tiene un rostrum largo (parte frontal), una región interorbital amplia (entre los ojos) y una caja craneana baja . [55] Se diferencia del de T. bolivaris en varias proporciones, que son más evidentes en los adultos que en los juveniles; [48] el cráneo de H. megacephalus es claramente más grande. [43] La placa cigomática es amplia e incluye una muesca cigomática bien desarrollada en su parte delantera. Su margen posterior está al nivel de la parte delantera del primer molar superior . [56] El arco cigomático (pómulo) es pesado. Los huesos nasal y premaxilares se extienden aproximadamente lo mismo hacia atrás. [31] La región interorbital es más estrecha hacia el frente y muestra un débil rebordeado en sus márgenes; [57] T. bolivaris es similar, pero tiene un rebordeado más fuerte [58] y H. megacephalus carece por completo de rebordeado. [59] El hueso parietal suele estar limitado al techo de la caja craneal y no se extiende hacia los lados, como ocurre en la mayoría de los T. bolivaris . [58] El hueso interparietal , parte del techo de la caja craneal, es grande. [31]
Los agujeros incisivos (aberturas en la parte frontal del paladar ) son cortos y no llegan entre los primeros molares; [40] son más largos en H. alfaroi . [37] El paladar óseo es largo y se extiende más allá del final de la fila molar y el margen posterior de los huesos maxilares . [60] Las fosas palatinas posterolaterales , que perforan el paladar cerca de los terceros molares, son pequeñas y pueden o no estar hundidas en una fosa . [61] Las vacuidades esfenopalatinas (aberturas en el techo de la fosa mesopterigoidea, detrás del paladar) también son pequeñas, [31] al igual que las bullas auditivas . [40] Como en la mayoría de los orizomíneos, está presente la fenestra subescamosa , una abertura en la parte posterior del cráneo. [62] El patrón de surcos y agujeros (aberturas) en el cráneo indica que la circulación de las arterias de la cabeza en T. talamancae sigue el patrón primitivo, como en la mayoría de especies similares pero a diferencia de Hylaeamys . [59]
La mandíbula (maxilar inferior) es menos robusta que en T. bolivaris . [63] El proceso coronoideo (un proceso en la parte posterior del hueso) es pequeño y el proceso capsular , que alberga la raíz del incisivo inferior , es pequeño. [31] El foramen mentoniano , ubicado en el diastema entre el incisivo inferior y el primer molar, se abre hacia el lado, como es habitual en los orizomíneos. [64] Las crestas maseterinas superior e inferior, que anclan algunos de los músculos masticadores, no se unen en una sola cresta y se extienden hacia adelante hasta debajo del primer molar. [65]
El incisivo superior es opistodonte , con el borde cortante orientado hacia atrás. [66] Como es habitual en los orizomíneos, los molares son braquidontes (de corona baja) y bunodontes (con las cúspides más altas que las crestas de conexión). [67] El primer molar superior es más estrecho que en T. bolivaris . En esta especie, pero a diferencia de muchas otras ratas arroceras, incluidas H. alfaroi y E. nitidus , el mesoflexo del segundo molar superior, que separa el paracono (una de las cúspides principales) del mesolofo (una cresta accesoria), no está dividido en dos por un puente de esmalte. [63] El hipoflexido del segundo molar inferior, el valle principal entre las cúspides, es muy largo y se extiende más de la mitad del diente; en este rasgo, la especie es nuevamente similar a T. bolivaris pero diferente a H. alfaroi . [68] Cada uno de los molares superiores tiene tres raíces (dos en el lado labial o externo y una en el lado lingual o interno) y cada uno de los molares inferiores tiene dos (una en la parte delantera y otra en la trasera); T. talamancae carece de las pequeñas raíces adicionales que están presentes en varios otros orizomíos, incluidas las especies de Euryoryzomys , Nephelomys y Handleyomys . [69]

Como es característico de Sigmodontinae, Transandinomys talamancae tiene un pene complejo, con el extremo distal (lejano) del báculo (hueso del pene) terminando en una estructura que consta de tres dígitos. [71] Como en la mayoría de los orizomíneos, el dígito central es más grande que los dos de los lados. [72] La superficie externa del pene está cubierta principalmente por pequeñas espinas , pero hay una amplia banda de tejido no espinoso. [73]
Algunas características de las glándulas accesorias en la región genital masculina varían entre los orizomídeos. En Transandinomys talamancae , [Nota 4] hay un solo par de glándulas prepuciales en el pene. Como es habitual en los sigmodontinos, hay dos pares de glándulas prostáticas ventrales y un solo par de glándulas prostáticas anterior y dorsal . Parte del extremo de la glándula vesicular está irregularmente doblada, no lisa como en la mayoría de los orizomídeos. [75]

El cariotipo en T. talamancae es variable. Muestras de dos localidades diferentes en Venezuela tienen 34 cromosomas y un número fundamental de 64 brazos cromosómicos (2n = 34, FN = 64). [77] Cuatro especímenes de otra localidad venezolana tienen cada uno un cariotipo diferente, con el número de cromosomas que varía de 40 a 42 y el número fundamental de 66 a quizás 67. [Nota 5] Los autosomas ( cromosomas no sexuales ) del cariotipo 2n = 34 tienen todos dos brazos principales, pero los cariotipos 2n = 40–42 incluyen varios autosomas acrocéntricos , que solo tienen un brazo principal. El cariotipo 2n = 34 incluye dos pares submetacéntricos grandes , que tienen dos brazos largos pero uno claramente más largo que el otro, y un par de cromosomas subtelocéntricos , con un brazo largo y uno mucho más corto, pero los cariotipos 2n = 40–42 carecen de los submetacéntricos y tienen otro par de subtelocéntricos. [79] Tanto las translocaciones robertsonianas (fusiones del brazo largo de un cromosoma con el brazo largo de otro y el brazo corto de uno con el brazo corto del otro) como las inversiones pericéntricas (inversiones de parte de un cromosoma que incluye el centrómero ) son necesarias para explicar la diferencia entre los dos grupos. Musser y sus colegas, al discutir estos cariotipos, asumieron que la muestra 2n = 40–42 era de dentro de una zona híbrida entre dos morfos cariotípicos. [80]
El cariotipo de una muestra ecuatoriana del norte del Golfo de Guayaquil es similar al de los animales venezolanos en 2n = 36, FN = 60; incluye cuatro pares acrocéntricos y dos pares subtelocéntricos y ningún submetacéntrico. En contraste, una muestra del sur del Golfo tenía 2n = 54, FN = 60, incluyendo 23 pares de acrocéntricos y cuatro pares de metacéntricos (con dos brazos igualmente largos). Musser y colegas calificaron la diferencia entre las dos formas ecuatorianas de "impresionante" [80] y notaron que se necesitaba más investigación para entender la diferenciación cariotípica dentro de la especie más completamente. [81] Tanto T. bolivaris como H. alfaroi tienen más cromosomas y brazos, en 2n = 58, FN = 80 y 2n = 60–62, FN = 100–104 respectivamente. [82] Hylaeamys megacephalus tiene 2n = 54, FN = 58–62 y el similar Hylaeamys perenensis tiene 2n = 52, FN = 62; estos cariotipos se parecen al de T. talamancae del sur de Ecuador . [83]
La distribución de Transandinomys talamancae se extiende desde el noroeste de Costa Rica al sur y al este hasta el norte de Venezuela y el suroeste de Ecuador, hasta 1.500 m (5.000 pies) sobre el nivel del mar. [32] Es una especie forestal y se encuentra tanto en bosques siempreverdes como caducifolios . [84] Aunque su distribución se superpone ampliamente con la de T. bolivaris , está más ampliamente distribuida en América del Sur debido a su mayor tolerancia a los hábitats de bosque seco. [85]
Transandinomys talamancae alcanza el límite norte de su área de distribución en Costa Rica, pero a excepción de un registro del extremo noroeste (en la provincia de Guanacaste, cerca del margen sur del lago de Nicaragua ), se conoce solo del tercio sureste del país. En contraste, T. bolivaris y H. alfaroi se encuentran más al norte, en Honduras y México respectivamente. Se encuentra en todo Panamá a bajas elevaciones. A lo largo de la costa del Pacífico en Colombia y Ecuador, se encuentra en la llanura costera y las estribaciones adyacentes de los Andes. [85] El registro conocido más al sur se encuentra en el extremo suroeste de Ecuador, pero la especie puede llegar hasta el cercano Perú. [84]
También se encuentra en todo el norte de Colombia a bajas elevaciones y en el oeste de Venezuela al oeste del lago de Maracaibo y al pie de la parte occidental de la Cordillera Costera venezolana al este del Parque Nacional Guatopo . [85] Hylaeamys megacephalus se encuentra más al este en la porción oriental de la cordillera costera, separada por la zona seca costera del Caribe Oriental. [43] Hay un registro del Delta del Orinoco en el noreste de Venezuela, bien dentro del rango de Hylaeamys megacephalus , pero Musser y sus colegas sugieren que esto se basa en especímenes mal etiquetados. [86] La especie también se ha encontrado en la estrecha franja entre los Llanos y los Andes ( Cordillera Oriental y Cordillera de Mérida ) en el este de Colombia y el noroeste de Venezuela. [85] Los Llanos sin bosques separan estas áreas de las poblaciones de Hylaeamys . Sin embargo, Hylaeamys perenensis [Nota 6] se encuentra más al sur a lo largo de las estribaciones orientales de la Cordillera Oriental en Colombia y es posible que las dos se superpongan en esta área. [43]
Transandinomys talamancae es una especie común, incluso abundante. [88] Su ecología fue estudiada por Theodore Fleming en la Zona del Canal de Panamá . [89] Vive en el suelo y es activo durante la noche . [90] El animal anida por encima del nivel del suelo y ocasionalmente ingresa a madrigueras también utilizadas por el ratón de abazones Liomys adspersus . [91] Su dieta es omnívora : incluye tanto material vegetal como semillas y frutas; como insectos adultos y larvas. [44]
Los machos tienden a viajar distancias más largas que las hembras. El tamaño promedio del área de distribución en el estudio de Fleming fue de 1,33 hectáreas (3,3 acres ); los machos tenían áreas de distribución más grandes en promedio. [92] Los especímenes que alguna vez fueron capturados tendieron a ser capturados con mayor frecuencia que aquellos que nunca habían sido capturados. [93] Fleming estimó que las densidades de población alcanzaron picos de hasta 4,3 por ha (1,7 por acre) a fines de la temporada de lluvias (octubre-noviembre), pero cayeron a casi cero alrededor de junio; sin embargo, estas cifras pueden ser subestimaciones. [94] En el centro de Venezuela, las densidades de población varían de 5,5 a 9,6 por ha (2,2 a 3,8 por acre). [ 95 ]
En Panamá, esta especie se reproduce durante todo el año sin variabilidad estacional aparente. [96] Según Mamíferos de Venezuela de Omar Linares , la actividad reproductiva es más alta en junio-julio y diciembre. [95] En el laboratorio, el período de gestación es de 28 días; [97] Linares informa de 20 a 30 días en la naturaleza. [95] Las hembras producen un promedio de seis camadas por año y hay de dos a cinco (promedio de 3,92) crías por camada, por lo que una sola hembra puede producir alrededor de 24 crías por año; [98] es probable que esto sea una sobreestimación porque la mayoría de las hembras no vivirían un año completo. Las hembras más grandes pueden tener camadas más numerosas. [99] Los animales alcanzan la madurez sexual cuando tienen menos de dos meses de edad; en el estudio de Fleming, algunas hembras con pelaje juvenil, probablemente de menos de 50 días de edad, ya estaban embarazadas. [100] El espécimen más antiguo que Fleming observó tenía nueve meses; [101] Estimó que era poco probable que los animales vivieran más de un año en estado salvaje [102] y que la edad media de muerte era de 2,9 meses. [103]
Diez especies de ácaros ( Gigantolaelaps aitkeni , [104] [Nota 7] Gigantolaelaps gilmorei , Gigantolaelaps oudemansi , Gigantolaelaps wolffsohni , Haemolaelaps glasgowi , Laelaps dearmasi , Laelaps pilifer , Laelaps thori , Mysolaelaps parvispinosus , [110] y Thopsis cricetidarum ), [111] trece niguas ( Aitkenius cunctatus , [112] Ascoschoengastia discrita , Eutrombicula alfreddugesi , Eutrombicula goeldii , Intercutestrix tryssa , Leptotrombidium panamensis , Myxacarus oscillatus , Pseudoschoengastia abditiva , Pseudoschoengastia bulbifera , Trombicula dunni y Trombicula keenani ), [113] y cuatro pulgas ( Jellisonia sp., Polygenis roberti , Polygenis klagesi y Polygenis dunni ) se han encontrado en T. talamancae en Panamá. [114] También se ha encontrado G. aitkeni sobre esta especie en Colombia. [105] Además, los piojos chupadores Hoplopleura nesoryzomydis y Hoplopleura oryzomydis se encuentran en T. talamancae . [115]
Transandinomys talamancae es una especie muy extendida y común que está catalogada como de “ Preocupación menor ” en la Lista Roja de la UICN . Se encuentra presente en numerosas áreas protegidas , tolera bien los hábitats alterados y no se conocen amenazas importantes. [2]