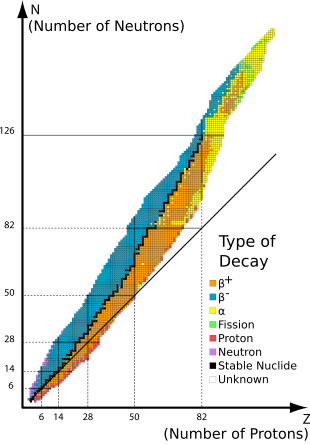
Los nucleidos estables son isótopos de un elemento químico cuyos nucleones están en una configuración que no les permite la energía sobrante necesaria para producir una emisión radiactiva. Los núcleos de dichos isótopos no son radiactivos y, a diferencia de los radionucleidos, no sufren desintegración radiactiva espontánea . [1] Cuando se hace referencia a estos nucleidos en relación con elementos específicos, se los suele llamar isótopos estables de ese elemento .
Los 80 elementos con uno o más isótopos estables comprenden un total de 251 nucleidos que no se ha demostrado que se desintegren utilizando el equipo actual. De estos 80 elementos, 26 tienen solo un isótopo estable y se denominan monoisotópicos . Los otros 56 tienen más de un isótopo estable. El estaño tiene diez isótopos estables, la mayor cantidad de cualquier elemento.
La mayoría de los nucleidos naturales son estables (unos 251; véase la lista al final de este artículo), y se sabe que unos 35 más (un total de 286) son radiactivos con vidas medias lo suficientemente largas (también conocidas) como para ocurrir de forma primordial. Si la vida media de un nucleido es comparable o mayor que la edad de la Tierra (4.500 millones de años), una cantidad significativa habrá sobrevivido desde la formación del Sistema Solar , y entonces se dice que es primordial . Entonces contribuirá de esa manera a la composición isotópica natural de un elemento químico. Los radioisótopos primordiales se detectan fácilmente con vidas medias tan cortas como 700 millones de años (p. ej., 235 U ). Este es el límite actual de detección, [ cita requerida ] ya que los nucleidos de vida más corta aún no se han detectado de forma indiscutible en la naturaleza, excepto cuando se han producido recientemente, como los productos de desintegración o la espalación de rayos cósmicos.
Muchos radioisótopos naturales (otros 53 aproximadamente, para un total de aproximadamente 339) presentan vidas medias aún más cortas que 700 millones de años, pero se forman recientemente, como productos secundarios de procesos de desintegración de nucleidos primordiales (por ejemplo, el radio a partir del uranio), o a partir de reacciones energéticas en curso, como los nucleidos cosmogénicos producidos por el bombardeo actual de la Tierra por rayos cósmicos (por ejemplo, el 14 C formado a partir del nitrógeno).
Se predice que algunos isótopos que se clasifican como estables (es decir, que no se ha observado radiactividad en ellos) tienen vidas medias extremadamente largas (a veces 10 18 años o más). [2] Si la vida media predicha cae dentro de un rango accesible experimentalmente, dichos isótopos tienen la posibilidad de pasar de la lista de nucleidos estables a la categoría radiactiva, una vez que se observa su actividad. Por ejemplo, 209 Bi y 180 W se clasificaban anteriormente como estables, pero se descubrió que eran alfa -activos en 2003. Sin embargo, dichos nucleidos no cambian su condición de primordiales cuando se descubre que son radiactivos.
Se cree que la mayoría de los isótopos estables de la Tierra se formaron en procesos de nucleosíntesis , ya sea en el Big Bang o en generaciones de estrellas que precedieron a la formación del Sistema Solar . Sin embargo, algunos isótopos estables también muestran variaciones en su abundancia en la Tierra como resultado de la desintegración de nucleidos radiactivos de larga duración. Estos productos de desintegración se denominan isótopos radiogénicos , para distinguirlos del grupo mucho más amplio de isótopos "no radiogénicos".
De los elementos químicos conocidos, 80 tienen al menos un nucleido estable. Se trata de los primeros 82 elementos, desde el hidrógeno hasta el plomo , con las dos excepciones, el tecnecio (elemento 43) y el prometio (elemento 61), que no tienen ningún nucleido estable. En 2023, había un total de 251 nucleidos "estables" conocidos. En esta definición, "estable" significa un nucleido que nunca se ha observado que se desintegra en el medio natural. Por lo tanto, estos elementos tienen vidas medias demasiado largas para ser medidas por cualquier medio, directo o indirecto.
Isótopos estables:
Estos últimos 26 se denominan elementos monoisotópicos . [3] El número medio de isótopos estables para los elementos que tienen al menos un isótopo estable es 251/80 = 3,1375.
La estabilidad de los isótopos se ve afectada por la proporción de protones y neutrones, y también por la presencia de ciertos números mágicos de neutrones o protones que representan capas cuánticas cerradas y llenas. Estas capas cuánticas corresponden a un conjunto de niveles de energía dentro del modelo de capas del núcleo; las capas llenas, como la capa llena de 50 protones del estaño, confieren una estabilidad inusual al nucleido. Como en el caso del estaño, un número mágico para Z , el número atómico, tiende a aumentar el número de isótopos estables para el elemento.
Al igual que en el caso de los electrones, que tienen el estado de energía más bajo cuando se encuentran en pares en un orbital dado, los nucleones (tanto protones como neutrones) exhiben un estado de energía más bajo cuando su número es par, en lugar de impar. Esta estabilidad tiende a prevenir la desintegración beta (en dos pasos) de muchos nucleidos pares-pares en otro nucleido par-par del mismo número de masa pero menor energía (y por supuesto con dos protones más y dos neutrones menos), porque la desintegración que se produce paso a paso tendría que pasar por un nucleido impar-impar de mayor energía. Por lo tanto, tales núcleos experimentan una doble desintegración beta (o se teoriza que lo hacen) con vidas medias varios órdenes de magnitud mayores que la edad del universo . Esto da lugar a un mayor número de nucleidos pares-pares estables, que representan 150 del total de 251. Los nucleidos pares-pares estables suman hasta tres isóbaros para algunos números másicos y hasta siete isótopos para algunos números atómicos.
Por el contrario, de los 251 nucleidos estables conocidos, solo cinco tienen un número impar de protones y un número impar de neutrones: hidrógeno-2 ( deuterio ), litio-6 , boro-10 , nitrógeno-14 y tantalio-180m . Además, solo cuatro nucleidos radiactivos impar-impares de origen natural tienen una vida media >10 9 años: potasio-40 , vanadio-50 , lantano-138 y lutecio-176 . Los nucleidos primordiales impar-impares son raros porque la mayoría de los núcleos impar-impares se desintegran en beta , porque los productos de desintegración son pares-pares y, por lo tanto, están más fuertemente unidos, debido a los efectos de apareamiento nuclear . [4]
Otro efecto de la inestabilidad de un número impar de cualquiera de los dos tipos de nucleones es que los elementos de número impar tienden a tener menos isótopos estables. De los 26 elementos monoisotópicos (aquellos con un solo isótopo estable), todos menos uno tienen un número atómico impar, y todos menos uno tienen un número par de neutrones: la única excepción a ambas reglas es el berilio .
El fin de los elementos estables ocurre después del plomo , en gran medida porque los núcleos con 128 neutrones (dos neutrones por encima del número mágico 126) son extraordinariamente inestables y sufren una desintegración alfa casi inmediata. [5] Esto contribuye a las vidas medias muy cortas del astato , el radón y el francio . Un fenómeno similar ocurre en mucha menor medida con 84 neutrones (dos neutrones por encima del número mágico 82), donde varios isótopos de elementos lantánidos sufren una desintegración alfa.
Entre los 251 nucleidos estables conocidos se encuentra el tantalio-180m, ya que, aunque su desintegración se deduce automáticamente por su condición de "metaestable", esto no se ha observado. Todos los isótopos "estables" (estables por observación, no por teoría) son los estados fundamentales de los núcleos, excepto el tantalio-180m, que es un isómero nuclear o estado excitado. El estado fundamental, el tantalio-180, es radiactivo y tiene una vida media de 8 horas; en cambio, la desintegración del isómero nuclear está prohibida de forma extremadamente estricta por las reglas de selección de paridad de espín. Se ha informado por observación directa que la vida media de la desintegración gamma del 180m Ta debe ser >10 15 años. Tampoco se han observado nunca otros modos posibles de desintegración del 180m Ta (desintegración beta, captura de electrones y desintegración alfa).
Se espera que la mejora de la sensibilidad experimental permita el descubrimiento de una radiactividad muy leve de algunos isótopos que ahora se consideran estables. Por ejemplo, en 2003 se informó que el bismuto-209 (el único isótopo primordial del bismuto) es muy levemente radiactivo, con una vida media de (1,9 ± 0,2) × 10 19 años, [6] [7] lo que confirma predicciones teóricas anteriores [8] de la física nuclear de que el bismuto-209 sufriría una desintegración alfa muy lenta .
Los isótopos que teóricamente se consideran inestables pero que no se ha observado que se desintegran se denominan observacionalmente estables . Actualmente hay 105 isótopos "estables" que son teóricamente inestables, 40 de los cuales se han observado en detalle sin ningún signo de desintegración, siendo el más ligero en cualquier caso el 36 Ar. Muchos nucleidos "estables" son " metaestables " en el sentido de que liberarían energía si se desintegraran, [9] y se espera que experimenten tipos muy raros de desintegración radiactiva , incluida la desintegración doble beta .
146 nucleidos de 62 elementos con números atómicos de 1 ( hidrógeno ) a 66 ( disprosio ), excepto 43 ( tecnecio ), 61 ( prometio ), 62 ( samario ) y 63 ( europio ), son teóricamente estables a cualquier tipo de desintegración nuclear, excepto la posibilidad teórica de desintegración de protones , que nunca se ha observado a pesar de las extensas búsquedas al respecto; y la fisión espontánea (FE), que es teóricamente posible para los nucleidos con números de masa atómica ≥ 93. [10]
Además del SF, otras rutas teóricas de desintegración para elementos más pesados incluyen: [10]
Entre ellos se incluyen todos los nucleidos de masa 165 o superior. El argón-36 es el nucleido "estable" más ligero conocido, que es teóricamente inestable. [10]
La positividad de la liberación de energía en estos procesos significa que están permitidos cinemáticamente (no violan la conservación de la energía) y, por lo tanto, en principio, pueden ocurrir. [10] No se observan debido a una supresión fuerte pero no absoluta, por las reglas de selección de paridad de espín (para desintegraciones beta y transiciones isoméricas) o por el espesor de la barrera de potencial (para desintegraciones alfa y de cúmulos y fisión espontánea).
Esta es una tabla resumen de la Lista de nucleidos . Tenga en cuenta que los números no son exactos y pueden cambiar ligeramente en el futuro, a medida que se observe que los nucleidos son radiactivos o se determinen nuevas vidas medias con cierta precisión.
Se han incluido los radionucleidos primordiales a efectos de comparación; están en cursiva y separados de la lista de nucleidos estables propiamente dicha.
Abreviaturas para la desintegración no observada prevista: [12] [2] [11]
α para desintegración alfa, B para desintegración beta, 2B para desintegración beta doble, E para captura de electrones, 2E para captura de electrones doble, IT para transición isomérica, SF para fisión espontánea, * para los nucleidos cuyas vidas medias tienen un límite inferior. La desintegración beta doble solo se ha incluido cuando la desintegración beta no es posible.
^ El tantalio-180m es un "isótopo metaestable", es decir, un isómero nuclear excitado del tantalio-180. Véase isótopos del tantalio . Sin embargo, la vida media de este isómero nuclear es tan larga que nunca se ha observado que se desintegra, y por lo tanto es un nucleido primordial "estable desde el punto de vista de las observaciones" , un isótopo raro del tantalio. Este es el único isómero nuclear con una vida media tan larga que nunca se ha observado que se desintegra. Por lo tanto, se incluye en esta lista.
^^ Durante mucho tiempo se creyó que el bismuto-209 era estable, debido a su vida media de 2,01×10 19 años, que es más de mil millones de veces la edad del universo.
§ El europio-151 y el samario-147 son nucleidos primordiales con vidas medias muy largas de 4,62×10 18 años y 1,066×10 11 años, respectivamente.