
En química , la IUPAC define una solución como "Una fase líquida o sólida que contiene más de una sustancia, cuando por conveniencia una (o más) sustancia, que se llama disolvente, se trata de forma diferente a las otras sustancias, que se llaman solutos. Cuando, como suele ser el caso, pero no necesariamente, la suma de las fracciones molares de solutos es pequeña en comparación con la unidad, la solución se llama solución diluida. Un superíndice adjunto al símbolo ∞ para una propiedad de una solución denota la propiedad en el límite de dilución infinita". [1] Un parámetro importante de una solución es la concentración , que es una medida de la cantidad de soluto en una cantidad dada de solución o disolvente. El término " solución acuosa " se utiliza cuando uno de los disolventes es agua . [2]
Homogéneo significa que los componentes de la mezcla forman una sola fase. Heterogéneo significa que los componentes de la mezcla son de diferente fase. Las propiedades de la mezcla (como concentración, temperatura y densidad) pueden distribuirse uniformemente a través del volumen, pero solo en ausencia de fenómenos de difusión o después de que se completen. Por lo general, la sustancia presente en mayor cantidad se considera el disolvente. Los disolventes pueden ser gases, líquidos o sólidos. Uno o más componentes presentes en la solución además del disolvente se denominan solutos. La solución tiene el mismo estado físico que el disolvente.
Si el disolvente es un gas , sólo los gases (no condensables) o los vapores (condensables) se disuelven en un conjunto dado de condiciones. Un ejemplo de una solución gaseosa es el aire (oxígeno y otros gases disueltos en nitrógeno). Dado que las interacciones entre moléculas gaseosas casi no juegan ningún papel, los gases no condensables forman soluciones más bien triviales. En la literatura, ni siquiera se clasifican como soluciones, sino que simplemente se abordan como mezclas homogéneas de gases. El movimiento browniano y la agitación molecular permanente de las moléculas de gas garantizan la homogeneidad de los sistemas gaseosos. Las mezclas gaseosas no condensables (por ejemplo, aire/CO 2 o aire/xenón) no se desmezclan espontáneamente, ni sedimentan, como capas de gas claramente estratificadas y separadas en función de su densidad relativa . Las fuerzas de difusión contrarrestan eficazmente las fuerzas gravitacionales en las condiciones normales que prevalecen en la Tierra. El caso de los vapores condensables es diferente: una vez que se alcanza la presión de vapor de saturación a una temperatura dada, el exceso de vapor se condensa al estado líquido .
Los líquidos disuelven gases, otros líquidos y sólidos. Un ejemplo de gas disuelto es el oxígeno en el agua, que permite a los peces respirar bajo el agua. Un ejemplo de líquido disuelto es el etanol en el agua, que se encuentra en las bebidas alcohólicas . Un ejemplo de sólido disuelto es el agua azucarada, que contiene sacarosa disuelta .
Si el disolvente es un sólido , entonces se pueden disolver gases, líquidos y sólidos.
La capacidad de un compuesto de disolverse en otro compuesto se denomina solubilidad . [ Aclaración necesaria ] Cuando un líquido puede disolverse completamente en otro líquido, los dos líquidos son miscibles . Dos sustancias que nunca pueden mezclarse para formar una solución se denominan inmiscibles .
Todas las soluciones tienen una entropía de mezcla positiva . Las interacciones entre diferentes moléculas o iones pueden ser energéticamente favorecidas o no. Si las interacciones son desfavorables, entonces la energía libre disminuye con el aumento de la concentración de soluto. En algún punto, la pérdida de energía supera la ganancia de entropía y no se pueden disolver más partículas de soluto [ aclaración necesaria ] ; se dice que la solución está saturada . Sin embargo, el punto en el que una solución puede saturarse puede cambiar significativamente con diferentes factores ambientales, como la temperatura , la presión y la contaminación. Para algunas combinaciones de soluto-disolvente, se puede preparar una solución sobresaturada aumentando la solubilidad (por ejemplo, aumentando la temperatura) para disolver más soluto y luego bajándola (por ejemplo, enfriando).
Por lo general, cuanto mayor sea la temperatura del disolvente, más cantidad de un determinado soluto sólido podrá disolver. Sin embargo, la mayoría de los gases y algunos compuestos presentan solubilidades que disminuyen con el aumento de la temperatura. Este comportamiento es el resultado de una entalpía de solución exotérmica . Algunos surfactantes presentan este comportamiento. La solubilidad de los líquidos en líquidos es generalmente menos sensible a la temperatura que la de los sólidos o los gases.
Las propiedades físicas de los compuestos, como el punto de fusión y el punto de ebullición, cambian cuando se añaden otros compuestos. En conjunto, se denominan propiedades coligativas . Hay varias formas de cuantificar la cantidad de un compuesto disuelto en los otros compuestos, denominadas colectivamente concentración . Algunos ejemplos son la molaridad , la fracción de volumen y la fracción molar .
Las propiedades de las soluciones ideales se pueden calcular mediante la combinación lineal de las propiedades de sus componentes. Si tanto el soluto como el disolvente existen en cantidades iguales (como en una solución de 50% de etanol y 50% de agua), los conceptos de "soluto" y "disolvente" pierden relevancia, pero la sustancia que se utiliza con más frecuencia como disolvente se designa normalmente como disolvente (en este ejemplo, agua).
En principio, todos los tipos de líquidos pueden comportarse como disolventes: gases nobles líquidos , metales fundidos, sales fundidas, redes covalentes fundidas y líquidos moleculares. En la práctica de la química y la bioquímica, la mayoría de los disolventes son líquidos moleculares. Se pueden clasificar en polares y apolares , según si sus moléculas poseen un momento dipolar eléctrico permanente . Otra distinción es si sus moléculas pueden formar enlaces de hidrógeno ( disolventes próticos y apróticos). El agua , el disolvente más utilizado, es a la vez polar y mantiene enlaces de hidrógeno.
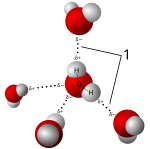
Las sales se disuelven en disolventes polares, formando iones positivos y negativos que son atraídos por los extremos negativo y positivo de la molécula del disolvente, respectivamente. Si el disolvente es agua, la hidratación se produce cuando los iones de soluto cargados quedan rodeados por moléculas de agua. Un ejemplo típico es el agua salada acuosa. Estas soluciones se denominan electrolitos . Siempre que la sal se disuelve en agua, se debe tener en cuenta la asociación de iones .
Los solutos polares se disuelven en disolventes polares, formando enlaces polares o puentes de hidrógeno. A modo de ejemplo, todas las bebidas alcohólicas son soluciones acuosas de etanol . Por otro lado, los solutos no polares se disuelven mejor en disolventes no polares. Algunos ejemplos son los hidrocarburos como el aceite y la grasa que se mezclan fácilmente, aunque son incompatibles con el agua.
Un ejemplo de la inmiscibilidad del petróleo y el agua es una fuga de petróleo de un petrolero averiado, que no se disuelve en el agua del océano sino que flota en la superficie.