

La presión de vapor [a] o presión de vapor de equilibrio es la presión que ejerce un vapor en equilibrio termodinámico con sus fases condensadas (sólida o líquida) a una temperatura determinada en un sistema cerrado . La presión de vapor de equilibrio es una indicación de la tendencia termodinámica de un líquido a evaporarse. Se relaciona con el equilibrio de las partículas que escapan del líquido (o sólido) en equilibrio con las que se encuentran en una fase de vapor coexistente. Una sustancia con una alta presión de vapor a temperaturas normales suele denominarse volátil . La presión ejercida por el vapor presente sobre una superficie líquida se conoce como presión de vapor. A medida que aumenta la temperatura de un líquido, las interacciones de atracción entre las moléculas del líquido se vuelven menos significativas en comparación con la entropía de esas moléculas en la fase gaseosa, lo que aumenta la presión de vapor. Por lo tanto, es probable que los líquidos con fuertes interacciones intermoleculares tengan presiones de vapor más pequeñas, mientras que ocurre lo contrario en el caso de interacciones más débiles.
La presión de vapor de cualquier sustancia aumenta de forma no lineal con la temperatura, lo que a menudo se describe mediante la relación Clausius-Clapeyron . El punto de ebullición a presión atmosférica de un líquido (también conocido como punto de ebullición normal ) es la temperatura a la que la presión de vapor es igual a la presión atmosférica ambiental. Con cualquier aumento incremental de esa temperatura, la presión de vapor se vuelve suficiente para superar la presión atmosférica y hacer que el líquido forme burbujas de vapor. La formación de burbujas en mayores profundidades de líquido requiere una temperatura ligeramente más alta debido a la mayor presión del fluido, debido a la presión hidrostática de la masa de fluido que se encuentra arriba. Más importante a poca profundidad es la temperatura más alta requerida para iniciar la formación de burbujas. La tensión superficial de la pared de la burbuja provoca una sobrepresión en las muy pequeñas burbujas iniciales.
La presión de vapor que un solo componente de una mezcla aporta a la presión total del sistema se llama presión parcial . Por ejemplo, el aire al nivel del mar, y saturado con vapor de agua a 20 °C, tiene presiones parciales de aproximadamente 2,3 kPa de agua, 78 kPa de nitrógeno , 21 kPa de oxígeno y 0,9 kPa de argón , totalizando 102,2 kPa, lo que constituye la base. para presión atmosférica estándar .
La presión de vapor se mide en unidades estándar de presión . El Sistema Internacional de Unidades (SI) reconoce la presión como una unidad derivada con la dimensión de fuerza por área y designa el pascal (Pa) como su unidad estándar. Un pascal es un newton por metro cuadrado (N·m −2 o kg·m −1 ·s −2 ).
La medición experimental de la presión de vapor es un procedimiento sencillo para presiones comunes entre 1 y 200 kPa. [1] Los resultados más precisos se obtienen cerca del punto de ebullición de la sustancia; Las mediciones inferiores a 1 kPa están sujetas a errores importantes. Los procedimientos suelen consistir en purificar la sustancia problema, aislarla en un recipiente, evacuar cualquier gas extraño y luego medir la presión de equilibrio de la fase gaseosa de la sustancia en el recipiente a diferentes temperaturas. Se logra una mayor precisión cuando se tiene cuidado de garantizar que toda la sustancia y su vapor estén a la temperatura prescrita. Esto se suele hacer, como ocurre con el uso de un isoteniscopio , sumergiendo el área de contención en un baño líquido.
Se pueden medir presiones de vapor de sólidos muy bajas utilizando el método de la celda de derrame de Knudsen .
En un contexto médico, la presión de vapor a veces se expresa en otras unidades, específicamente en milímetros de mercurio (mmHg) . El conocimiento preciso de la presión de vapor es importante para los anestésicos inhalatorios volátiles , la mayoría de los cuales son líquidos a temperatura corporal pero tienen una presión de vapor relativamente alta.
La ecuación de Antoine [2] [3] es una expresión matemática pragmática de la relación entre la presión de vapor y la temperatura de sustancias líquidas o sólidas puras. Se obtiene mediante ajuste de curvas y se adapta al hecho de que la presión de vapor suele ser creciente y cóncava en función de la temperatura. La forma básica de la ecuación es:
y se puede transformar en esta forma explícita de temperatura:
dónde:
A veces se utiliza una forma más simple de la ecuación con solo dos coeficientes:
que se puede transformar en:
Las sublimaciones y vaporizaciones de la misma sustancia tienen conjuntos separados de coeficientes de Antoine, al igual que los componentes de las mezclas. [2] Cada parámetro establecido para un compuesto específico solo es aplicable en un rango de temperatura específico. Generalmente, los rangos de temperatura se eligen para mantener la precisión de la ecuación entre un 8 y un 10 por ciento. Para muchas sustancias volátiles, se encuentran disponibles varios conjuntos diferentes de parámetros que se utilizan para diferentes rangos de temperatura. La ecuación de Antoine tiene poca precisión con cualquier conjunto de parámetros cuando se usa desde el punto de fusión de un compuesto hasta su temperatura crítica. La precisión también suele ser deficiente cuando la presión de vapor es inferior a 10 Torr debido a las limitaciones del aparato [ cita necesaria ] utilizado para establecer los valores de los parámetros de Antoine.
La ecuación de Wagner [4] proporciona "uno de los mejores" [5] ajustes a los datos experimentales, pero es bastante compleja. Expresa la presión de vapor reducida en función de la temperatura reducida.

Como tendencia general, la presión de vapor de los líquidos a temperatura ambiente aumenta al disminuir los puntos de ebullición. Esto se ilustra en la tabla de presión de vapor (ver a la derecha) que muestra gráficos de las presiones de vapor versus temperaturas para una variedad de líquidos. [6] En el punto de ebullición normal de un líquido, la presión de vapor es igual a la presión atmosférica estándar definida como 1 atmósfera, [7] 760 Torr, 101,325 kPa o 14,69595 psi.
Por ejemplo, a cualquier temperatura determinada, el cloruro de metilo tiene la presión de vapor más alta de todos los líquidos del cuadro. También tiene el punto de ebullición normal más bajo a -24,2 °C (-11,6 °F), que es donde la curva de presión de vapor del cloruro de metilo (la línea azul) se cruza con la línea de presión horizontal de una atmósfera ( atm ) de presión de vapor absoluta. .
Aunque la relación entre la presión de vapor y la temperatura no es lineal, el gráfico utiliza un eje vertical logarítmico para producir líneas ligeramente curvas, por lo que un gráfico puede representar muchos líquidos. Se obtiene una línea casi recta cuando se traza el logaritmo de la presión de vapor frente a 1/(T + 230) [8] donde T es la temperatura en grados Celsius. La presión de vapor de un líquido en su punto de ebullición es igual a la presión del entorno que lo rodea.
La ley de Raoult da una aproximación a la presión de vapor de mezclas de líquidos. Afirma que la actividad (presión o fugacidad ) de una mezcla monofásica es igual a la suma ponderada en fracciones molares de las presiones de vapor de los componentes:
donde es la presión de vapor de la mezcla, es la fracción molar del componente en la fase líquida y es la fracción molar del componente en la fase de vapor, respectivamente. es la presión de vapor del componente . La ley de Raoult es aplicable sólo a no electrolitos (especies sin carga); es más apropiado para moléculas no polares con atracciones intermoleculares débiles (como las fuerzas de London ).
Se dice que los sistemas que tienen presiones de vapor superiores a las indicadas por la fórmula anterior tienen desviaciones positivas. Tal desviación sugiere una atracción intermolecular más débil que en los componentes puros, de modo que se puede pensar que las moléculas están "mantenidas" en la fase líquida con menos fuerza que en el líquido puro. Un ejemplo es el azeótropo de aproximadamente 95% de etanol y agua. Debido a que la presión de vapor del azeótropo es mayor que la predicha por la ley de Raoult, hierve a una temperatura inferior a la de cualquiera de los componentes puros.
También hay sistemas con desviaciones negativas que tienen presiones de vapor inferiores a las esperadas. Tal desviación es evidencia de una atracción intermolecular más fuerte entre los constituyentes de la mezcla que la que existe en los componentes puros. Por lo tanto, las moléculas se "retienen" en el líquido con más fuerza cuando está presente una segunda molécula. Un ejemplo es una mezcla de triclorometano (cloroformo) y 2-propanona (acetona), que hierve por encima del punto de ebullición de cualquiera de los componentes puros.
Las desviaciones negativas y positivas se pueden utilizar para determinar los coeficientes de actividad termodinámica de los componentes de las mezclas.
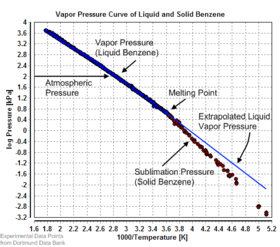
La presión de vapor de equilibrio se puede definir como la presión que se alcanza cuando una fase condensada está en equilibrio con su propio vapor. En el caso de un sólido en equilibrio, como un cristal , esto se puede definir como la presión cuando la tasa de sublimación de un sólido coincide con la tasa de deposición de su fase de vapor. Para la mayoría de los sólidos, esta presión es muy baja, pero algunas excepciones notables son la naftaleno , el hielo seco (la presión de vapor del hielo seco es de 5,73 MPa (831 psi, 56,5 atm) a 20 °C, lo que provoca que la mayoría de los contenedores sellados se rompan) y hielo. Todos los materiales sólidos tienen presión de vapor. Sin embargo, debido a sus valores a menudo extremadamente bajos, la medición puede resultar bastante difícil. Las técnicas típicas incluyen el uso de termogravimetría y transpiración de gases.
Existen varios métodos para calcular la presión de sublimación (es decir, la presión de vapor) de un sólido. Un método consiste en estimar la presión de sublimación a partir de presiones de vapor de líquido extrapoladas (del líquido sobreenfriado), si se conoce el calor de fusión , utilizando esta forma particular de la relación Clausius-Clapeyron: [9]
dónde:
Este método supone que el calor de fusión es independiente de la temperatura, ignora las temperaturas de transición adicionales entre diferentes fases sólidas y proporciona una estimación justa de las temperaturas no muy alejadas del punto de fusión. También muestra que la presión de sublimación es menor que la presión de vapor líquido extrapolada (Δ fus H > 0) y la diferencia crece con el aumento de la distancia desde el punto de fusión.

Como todos los líquidos, el agua hierve cuando su presión de vapor alcanza la presión circundante. En la naturaleza, la presión atmosférica es menor en las elevaciones más altas y el agua hierve a una temperatura más baja. La temperatura de ebullición del agua a presiones atmosféricas se puede aproximar mediante la ecuación de Antoine :
o transformado en esta forma explícita de temperatura:
donde la temperatura es el punto de ebullición en grados Celsius y la presión en torr .
La regla de Dühring establece que existe una relación lineal entre las temperaturas a las que dos soluciones ejercen la misma presión de vapor.
La siguiente tabla es una lista de una variedad de sustancias ordenadas según la presión de vapor creciente (en unidades absolutas).
Existen varios métodos empíricos para estimar la presión de vapor a partir de la estructura molecular de moléculas orgánicas. Algunos ejemplos son el método SIMPOL.1, [13] el método de Moller et al., [9] y la EVAPORACIÓN (Estimación de la presión de vapor de compuestos orgánicos, contabilidad de la temperatura, efectos intramoleculares y de no aditividad). [14] [15]
En meteorología , el término presión de vapor significa la presión parcial del vapor de agua en la atmósfera, aunque no esté en equilibrio. [16] Esto difiere de su significado en otras ciencias. [16] Según el Glosario de Meteorología de la Sociedad Meteorológica Estadounidense , la presión de vapor de saturación se refiere propiamente a la presión de vapor de equilibrio del agua sobre una superficie plana de agua líquida o hielo sólido, y es función únicamente de la temperatura y de si la fase condensada es líquida. o sólido. [17] La humedad relativa se define en relación con la presión de vapor de saturación. [18] La presión de vapor de equilibrio no requiere que la fase condensada sea una superficie plana; podría consistir en pequeñas gotas que posiblemente contengan solutos (impurezas), como una nube . [19] [18] La presión de vapor de equilibrio puede diferir significativamente de la presión de vapor de saturación dependiendo del tamaño de las gotas y la presencia de otras partículas que actúan como núcleos de condensación de nubes . [19] [18]
Sin embargo, estos términos se usan de manera inconsistente y algunos autores usan "presión de vapor de saturación" fuera del significado estricto dado por el Glosario AMS . Por ejemplo, un texto sobre convección atmosférica dice: "El efecto Kelvin hace que la presión de vapor de saturación sobre la superficie curva de la gota sea mayor que la presión sobre una superficie plana de agua" (énfasis añadido). [20]
El término aún vigente presión de vapor de saturación deriva de la teoría obsoleta de que el vapor de agua se disuelve en el aire y que el aire a una temperatura determinada sólo puede contener una cierta cantidad de agua antes de "saturarse". [18] En realidad, como lo establece la ley de Dalton (conocida desde 1802), la presión parcial del vapor de agua o de cualquier sustancia no depende en absoluto del aire, y la temperatura relevante es la del líquido. [18] Sin embargo, la creencia errónea persiste entre el público e incluso entre los meteorólogos, ayudada por los términos engañosos presión de saturación y sobresaturación y la definición relacionada de humedad relativa . [18]