Sir Joseph John Thomson OM FRS [1] (18 de diciembre de 1856 – 30 de agosto de 1940) fue un físico británico y premio Nobel de Física , a quien se le atribuye el descubrimiento del electrón , la primera partícula subatómica encontrada.
En 1897, Thomson demostró que los rayos catódicos estaban compuestos de partículas cargadas negativamente desconocidas hasta ahora (ahora llamadas electrones), que calculó que debían tener cuerpos mucho más pequeños que los átomos y una relación carga-masa muy grande . [2] A Thomson también se le atribuye haber encontrado la primera evidencia de isótopos de un elemento estable (no radiactivo) en 1913, como parte de su exploración de la composición de los rayos del canal (iones positivos). Sus experimentos para determinar la naturaleza de las partículas cargadas positivamente, con Francis William Aston , fueron el primer uso de la espectrometría de masas y condujeron al desarrollo del espectrógrafo de masas. [2] [3]
Thomson recibió el Premio Nobel de Física en 1906 por su trabajo sobre la conducción de electricidad en gases. [4] Thomson también fue profesor, y siete de sus alumnos ganaron premios Nobel: Ernest Rutherford (Química 1908), Lawrence Bragg (Física 1915), Charles Barkla (Física 1917), Francis Aston (Química 1922), Charles Thomson Rees Wilson (Física 1927), Owen Richardson (Física 1928) y Edward Victor Appleton (Física 1947). [5] Sólo el historial de tutoría de Arnold Sommerfeld ofrece una lista comparable de estudiantes de alto rendimiento.
Joseph John Thomson nació el 18 de diciembre de 1856 en Cheetham Hill , Manchester , Lancashire , Inglaterra. Su madre, Emma Swindells, provenía de una familia textil local. Su padre, Joseph James Thomson, dirigía una librería anticuaria fundada por el bisabuelo de Thomson. Tenía un hermano, Frederick Vernon Thomson, que era dos años menor que él. [6] JJ Thomson era un anglicano reservado pero devoto . [7] [8] [9]
Su educación inicial fue en pequeñas escuelas privadas donde demostró un talento e interés sobresalientes por la ciencia. En 1870, fue admitido en el Owens College de Manchester (ahora Universidad de Manchester ) a la inusualmente joven edad de 14 años y quedó bajo la influencia de Balfour Stewart , profesor de Física, quien inició a Thomson en la investigación física. [10] Thomson comenzó a experimentar con la electrificación por contacto y pronto publicó su primer artículo científico. [11] Sus padres planearon inscribirlo como aprendiz de ingeniero en Sharp, Stewart & Co , un fabricante de locomotoras, pero estos planes se vieron truncados cuando su padre murió en 1873. [6]
Se trasladó al Trinity College, Cambridge , en 1876. En 1880, obtuvo su licenciatura en matemáticas ( segundo Wrangler en los Tripos [12] y segundo premio Smith ). [13] Solicitó y se convirtió en miembro del Trinity College en 1881. [14] Recibió su Maestría en Artes (con el Premio Adams ) en 1883. [13]
En 1890, Thomson se casó con Rose Elisabeth Paget en la iglesia de Santa María la Menor . Rose, que era hija de Sir George Edward Paget , médico y luego profesor Regius de Física en Cambridge , estaba interesada en la física. A partir de 1882, las mujeres pudieron asistir a manifestaciones y conferencias en la Universidad de Cambridge. Rose asistió a demostraciones y conferencias, entre ellas las de Thomson, lo que llevó a su relación. [15]
Tuvieron dos hijos: George Paget Thomson , que también recibió el Premio Nobel por su trabajo sobre las propiedades ondulatorias del electrón, y Joan Paget Thomson (más tarde Charnock), [16] que se convirtió en autora y escribió libros para niños, no- ficción y biografías. [17]
El 22 de diciembre de 1884, Thomson fue nombrado profesor Cavendish de Física en la Universidad de Cambridge . [2] El nombramiento causó una considerable sorpresa, dado que candidatos como Osborne Reynolds o Richard Glazebrook eran mayores y tenían más experiencia en trabajos de laboratorio. Thomson era conocido por su trabajo como matemático, donde se le reconocía un talento excepcional. [18]
Fue galardonado con el Premio Nobel en 1906, "en reconocimiento a los grandes méritos de sus investigaciones teóricas y experimentales sobre la conducción de electricidad por gases". Fue nombrado caballero en 1908 y nombrado miembro de la Orden del Mérito en 1912. En 1914, pronunció la Conferencia Romanes en Oxford sobre "La teoría atómica". En 1918, se convirtió en Maestro del Trinity College de Cambridge , donde permaneció hasta su muerte. Murió el 30 de agosto de 1940; sus cenizas reposan en la Abadía de Westminster , [19] cerca de las tumbas de Sir Isaac Newton y su antiguo alumno Ernest Rutherford . [20]
Rutherford lo sucedió como profesor Cavendish de Física . Seis de los asistentes de investigación y colegas jóvenes de Thomson ( Charles Glover Barkla , [21] Niels Bohr , [22] Max Born , [23] William Henry Bragg , Owen Willans Richardson [24] y Charles Thomson Rees Wilson [1] ) ganaron premios Nobel. en física, y dos ( Francis William Aston [25] y Ernest Rutherford [26] ) ganaron premios Nobel de química. El hijo de Thomson ( George Paget Thomson ) también ganó el Premio Nobel de Física en 1937 por demostrar las propiedades ondulatorias de los electrones. [27]
El trabajo de maestría premiado de Thomson, Tratado sobre el movimiento de anillos de vórtice , muestra su temprano interés en la estructura atómica. [4] En él, Thomson describió matemáticamente los movimientos de la teoría de los vórtices de los átomos de William Thomson . [18]
Thomson publicó varios artículos que abordan cuestiones matemáticas y experimentales del electromagnetismo. Examinó la teoría electromagnética de la luz de James Clerk Maxwell , introdujo el concepto de masa electromagnética de una partícula cargada y demostró que un cuerpo cargado en movimiento aparentemente aumentaría de masa. [18]
Gran parte de su trabajo en modelado matemático de procesos químicos puede considerarse como química computacional temprana . [2] En un trabajo posterior, publicado en forma de libro como Aplicaciones de la dinámica a la física y la química (1888), Thomson abordó la transformación de la energía en términos matemáticos y teóricos, sugiriendo que toda energía podría ser cinética. [18] Su siguiente libro, Notas sobre investigaciones recientes en electricidad y magnetismo (1893), se basó en el Tratado de Maxwell sobre electricidad y magnetismo , y en ocasiones se lo denominó "el tercer volumen de Maxwell". [4] En él, Thomson enfatizó los métodos físicos y la experimentación e incluyó extensas figuras y diagramas de aparatos, incluidos varios para el paso de la electricidad a través de gases. [18] Su tercer libro, Elementos de la teoría matemática de la electricidad y el magnetismo (1895) [28] fue una introducción legible a una amplia variedad de temas y alcanzó considerable popularidad como libro de texto. [18]

Posteriormente se publicó una serie de cuatro conferencias impartidas por Thomson en una visita a la Universidad de Princeton en 1896 como Descarga de electricidad a través de gases (1897). Thomson también presentó una serie de seis conferencias en la Universidad de Yale en 1904. [4]
Varios científicos, como William Prout y Norman Lockyer , habían sugerido que los átomos se formaban a partir de una unidad más fundamental, pero imaginaban que esta unidad tendría el tamaño del átomo más pequeño, el hidrógeno. Thomson en 1897 fue el primero en sugerir que una de las unidades fundamentales del átomo era más de 1.000 veces más pequeña que un átomo, sugiriendo la partícula subatómica ahora conocida como electrón. Thomson descubrió esto a través de sus exploraciones sobre las propiedades de los rayos catódicos. Thomson hizo su sugerencia el 30 de abril de 1897 tras descubrir que los rayos catódicos (en ese momento conocidos como rayos de Lenard ) podían viajar a través del aire mucho más lejos de lo esperado para una partícula del tamaño de un átomo. [29] Estimó la masa de los rayos catódicos midiendo el calor generado cuando los rayos golpean una unión térmica y comparándolo con la desviación magnética de los rayos. Sus experimentos sugirieron no sólo que los rayos catódicos eran más de 1.000 veces más ligeros que el átomo de hidrógeno, sino también que su masa era la misma en cualquier tipo de átomo del que procedieran. Concluyó que los rayos estaban compuestos de partículas muy ligeras y cargadas negativamente que constituían un componente universal de los átomos. Llamó a las partículas "corpúsculos", pero los científicos posteriores prefirieron el nombre electrón , que había sido sugerido por George Johnstone Stoney en 1891, antes del descubrimiento real de Thomson. [30]
En abril de 1897, Thomson sólo tenía los primeros indicios de que los rayos catódicos podían desviarse eléctricamente (investigadores anteriores como Heinrich Hertz habían pensado que no era posible). Un mes después del anuncio de Thomson sobre el corpúsculo, descubrió que podía desviar de forma fiable los rayos mediante un campo eléctrico si evacuaba el tubo de descarga a una presión muy baja. Al comparar la deflexión de un haz de rayos catódicos por campos eléctricos y magnéticos, obtuvo mediciones más sólidas de la relación masa-carga que confirmaron sus estimaciones anteriores. [31] Este se convirtió en el medio clásico para medir la relación carga-masa del electrón. (La carga en sí no se midió hasta el experimento de la gota de aceite de Robert A. Millikan en 1909).
Thomson creía que los corpúsculos surgían de los átomos del gas traza dentro de sus tubos de rayos catódicos . Por tanto, concluyó que los átomos eran divisibles y que los corpúsculos eran sus componentes básicos. En 1904, Thomson sugirió un modelo del átomo, planteando la hipótesis de que se trataba de una esfera de materia positiva dentro de la cual las fuerzas electrostáticas determinaban la posición de los corpúsculos. [2] Para explicar la carga neutra general del átomo, propuso que los corpúsculos estaban distribuidos en un mar uniforme de carga positiva. En este " modelo de pudín de ciruelas ", los electrones se veían incrustados en la carga positiva como pasas en un pudín de ciruelas (aunque en el modelo de Thomson no estaban estacionarios, sino que orbitaban rápidamente). [32] [33]
Thomson hizo el descubrimiento casi al mismo tiempo que Walter Kaufmann y Emil Wiechert descubrieron la relación correcta entre masa y carga de estos rayos catódicos (electrones). [34]

En 1912, como parte de su exploración de la composición de las corrientes de partículas cargadas positivamente conocidas entonces como rayos de canal , Thomson y su asistente de investigación FW Aston canalizaron una corriente de iones de neón a través de un campo magnético y eléctrico y midieron su deflexión colocando una placa fotográfica a su paso. [6] Observaron dos manchas de luz en la placa fotográfica (ver imagen a la derecha), lo que sugería dos parábolas de desviación diferentes, y concluyeron que el neón está compuesto por átomos de dos masas atómicas diferentes (neón-20 y neón-22). , es decir de dos isótopos . [35] [36] Esta fue la primera evidencia de isótopos de un elemento estable; Frederick Soddy había propuesto previamente la existencia de isótopos para explicar la desintegración de determinados elementos radiactivos .
La separación de Thomson de isótopos de neón por su masa fue el primer ejemplo de espectrometría de masas , que posteriormente fue mejorada y desarrollada hasta convertirse en un método general por FW Aston y por AJ Dempster . [2] [3]
Anteriormente, los físicos debatieron si los rayos catódicos eran inmateriales como la luz ("algún proceso en el éter ") o si eran "de hecho totalmente materiales, y... marcan los caminos de las partículas de materia cargadas con electricidad negativa", citando a Thomson. [31] La hipótesis etérea era vaga, [31] pero la hipótesis de las partículas era lo suficientemente definida como para que Thomson la probara.
Thomson fue el primero en investigar la desviación magnética de los rayos catódicos. Los rayos catódicos se generaban en el tubo lateral a la izquierda del aparato y pasaban a través del ánodo hasta la campana de cristal principal , donde eran desviados por un imán. Thomson detectó su camino por la fluorescencia en una pantalla cuadrada en el frasco. Descubrió que cualquiera que fuera el material del ánodo y el gas del recipiente, la desviación de los rayos era la misma, lo que sugería que los rayos tenían la misma forma cualquiera que fuera su origen. [37]
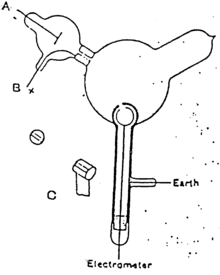
Si bien los partidarios de la teoría etérea aceptaron la posibilidad de que se produzcan partículas cargadas negativamente en los tubos de Crookes , [ cita requerida ] creían que son un mero subproducto y que los rayos catódicos en sí son inmateriales. [ cita necesaria ] Thomson se propuso investigar si realmente podía separar la carga de los rayos.
Thomson construyó un tubo de Crookes con un electrómetro colocado a un lado, fuera del camino directo de los rayos catódicos. Thomson pudo rastrear la trayectoria del rayo observando el parche fosforescente que creó donde golpeó la superficie del tubo. Thomson observó que el electrómetro registraba una carga sólo cuando desviaba el rayo catódico hacia él con un imán. Concluyó que la carga negativa y los rayos eran lo mismo. [29]

En mayo-junio de 1897, Thomson investigó si los rayos podían ser desviados por un campo eléctrico. [6] Los experimentadores anteriores no habían observado esto, pero Thomson creía que sus experimentos eran defectuosos porque sus tubos contenían demasiado gas.
Thomson construyó un tubo Crookes con un mejor vacío. Al comienzo del tubo estaba el cátodo desde donde se proyectaban los rayos. Los rayos se afilaban hasta formar un haz mediante dos hendiduras metálicas: la primera de estas hendiduras hacía las veces de ánodo y la segunda estaba conectada a la tierra. Luego, el haz pasó entre dos placas de aluminio paralelas, que produjeron un campo eléctrico entre ellas cuando estaban conectadas a una batería. El extremo del tubo era una gran esfera donde el rayo impactaría en el vidrio, creando una mancha brillante. Thomson pegó una escala en la superficie de esta esfera para medir la deflexión del haz. Cualquier haz de electrones colisionaría con algunos átomos de gas residuales dentro del tubo de Crookes, ionizándolos y produciendo electrones e iones en el tubo ( carga espacial ); en experimentos anteriores, esta carga espacial apantallaba eléctricamente el campo eléctrico aplicado externamente. Sin embargo, en el tubo Crookes de Thomson, la densidad de los átomos residuales era tan baja que la carga espacial de los electrones e iones era insuficiente para proteger eléctricamente el campo eléctrico aplicado externamente, lo que permitió a Thomson observar con éxito la deflexión eléctrica.
Cuando la placa superior se conectó al polo negativo de la batería y la placa inferior al polo positivo, el parche brillante se movió hacia abajo, y cuando se invirtió la polaridad, el parche se movió hacia arriba.
En su experimento clásico, Thomson midió la relación masa-carga de los rayos catódicos midiendo cuánto eran desviados por un campo magnético y comparándolo con la deflexión eléctrica. Utilizó el mismo aparato que en su experimento anterior, pero colocó el tubo de descarga entre los polos de un gran electroimán. Descubrió que la relación masa-carga era mil veces menor que la de un ion hidrógeno (H + ), lo que sugería que las partículas eran muy ligeras y/o muy cargadas. [31] Significativamente, los rayos de cada cátodo produjeron la misma relación masa-carga. Esto contrasta con los rayos anódicos (ahora se sabe que surgen de iones positivos emitidos por el ánodo), donde la relación masa-carga varía de un ánodo a otro. El propio Thomson se mantuvo crítico con lo que establecía su trabajo, y en su discurso de aceptación del Premio Nobel se refirió a "corpúsculos" en lugar de "electrones".
Los cálculos de Thomson se pueden resumir de la siguiente manera (en su notación original, usando F en lugar de E para el campo eléctrico y H en lugar de B para el campo magnético):
La deflexión eléctrica está dada por , donde Θ es la deflexión eléctrica angular, F es la intensidad eléctrica aplicada, e es la carga de las partículas de los rayos catódicos, l es la longitud de las placas eléctricas, m es la masa de las partículas de los rayos catódicos y v es la velocidad de las partículas del rayo catódico. La deflexión magnética viene dada por , donde φ es la deflexión magnética angular y H es la intensidad del campo magnético aplicado.
El campo magnético se varió hasta que las desviaciones magnética y eléctrica fueron las mismas, cuando . Esto se puede simplificar para dar . La deflexión eléctrica se midió por separado para dar Θ y H, se conocían F y l, por lo que se pudo calcular m/e.
Como los rayos catódicos llevan una carga de electricidad negativa, son desviados por una fuerza electrostática como si estuvieran electrificados negativamente, y sobre ellos actúa una fuerza magnética de la misma forma en que esta fuerza actuaría sobre un cuerpo electrificado negativamente que se mueve a lo largo de la trayectoria. trayectoria de estos rayos, no puedo evitar la conclusión de que son cargas de electricidad negativa transportadas por partículas de materia.
— JJ Thomson [31]
En cuanto a la fuente de estas partículas, Thomson creía que emergían de las moléculas de gas en las proximidades del cátodo.
Si, en el campo eléctrico muy intenso en las proximidades del cátodo, las moléculas del gas se disocian y se dividen, no en los átomos químicos ordinarios, sino en estos átomos primordiales, que para abreviar llamaremos corpúsculos; y si estos corpúsculos estuvieran cargados de electricidad y proyectados desde el cátodo por el campo eléctrico, se comportarían exactamente como los rayos catódicos.
— JJ Thomson [38]
Thomson imaginó que el átomo estaba formado por estos corpúsculos que orbitaban en un mar de carga positiva; este era su modelo de pudín de ciruelas . Más tarde se demostró que este modelo era incorrecto cuando su alumno Ernest Rutherford demostró que la carga positiva se concentra en el núcleo del átomo.
En 1905, Thomson descubrió la radiactividad natural del potasio . [39]
En 1906, Thomson demostró que el hidrógeno tenía un solo electrón por átomo. Las teorías anteriores permitían varios números de electrones. [40] [41]



Thomson fue elegido miembro de la Royal Society (FRS) [1] [42] y nombrado miembro de la Cátedra Cavendish de Física Experimental en el Laboratorio Cavendish de la Universidad de Cambridge en 1884. [2] Thomson ganó numerosos premios y honores durante su carrera. incluido:
Thomson fue elegido miembro de la Royal Society [1] el 12 de junio de 1884 y sirvió como presidente de la Royal Society de 1915 a 1920.
Thomson fue elegido miembro honorario internacional de la Academia Estadounidense de Artes y Ciencias en 1902, miembro internacional de la Sociedad Filosófica Estadounidense en 1903 y de la Academia Nacional de Ciencias de los Estados Unidos en 1903. [43] [44] [45]
En noviembre de 1927, Thomson inauguró el edificio Thomson, llamado así en su honor, en la Leys School de Cambridge. [46]
En 1991, el Thomson (símbolo: Th) fue propuesto como unidad para medir la relación masa-carga en espectrometría de masas en su honor. [47]
JJ Thomson Avenue, en el sitio de West Cambridge de la Universidad de Cambridge , lleva el nombre de Thomson. [48]
El Premio Medalla Thomson , patrocinado por la Fundación Internacional de Espectrometría de Masas , lleva el nombre de Thomson. [49]
La Medalla y Premio Joseph Thomson del Instituto de Física lleva el nombre de Thomson. [50]
Entre sus alumnos premios Nobel se encuentran Rutherford, Aston, Wilson, Bragg, Barkla, Richardson y Appleton.
Trabajó con JJ Thomson en el Laboratorio Cavendish de Cambridge.
realizó una estancia en Cambridge, donde aprovechó el seguimiento de los trabajos experimentales que se realizaban en el Laboratorio Cavendish bajo la dirección de Sir JJ Thomson.
Born luego fue a Cambridge por un corto tiempo para estudiar con Larmor y JJ Thomson.
Richardson, graduado (1900) del Trinity College de Cambridge y alumno de JJ Thomson en el Laboratorio Cavendish.
A finales de 1909 aceptó la invitación de Sir JJ Thomson para trabajar como su asistente en el Laboratorio Cavendish.
como estudiante de investigación en el Laboratorio Cavendish bajo la dirección de JJ Thomson.
llevó a cabo experimentos sobre el comportamiento de los electrones... que demostraron que los electrones se comportan como ondas...
Según la hipótesis de JJ Thomson, los átomos están formados por sistemas de anillos giratorios de electrones.
Marcus Chown dice que la verdad no es exactamente como sugieren los libros de historia.
La Medalla Thomson lleva el nombre de Sir JJ Thomson, responsable del primer espectrógrafo de masas.


