Una proteína de transporte de membrana es una proteína de membrana involucrada en el movimiento de iones , moléculas pequeñas y macromoléculas , como otra proteína , a través de una membrana biológica . Las proteínas de transporte son proteínas transmembrana integrales ; es decir, existen permanentemente dentro y abarcan la membrana a través de la cual transportan sustancias. Las proteínas pueden ayudar en el movimiento de sustancias por difusión facilitada , transporte activo , ósmosis o difusión inversa . Los dos tipos principales de proteínas involucradas en dicho transporte se clasifican ampliamente como canales o transportadores (también conocidos como transportadores o permeasas ). Los ejemplos de proteínas canal/transportadoras incluyen el uniportador GLUT 1 , los canales de sodio y los canales de potasio . Los transportadores de solutos y los SLC atípicos [1] son transportadores activos o facilitadores secundarios en humanos. [2] [3] Colectivamente, los transportadores y canales de membrana se conocen como transportoma. [4] Los transportomas gobiernan la entrada y salida celular no solo de iones y nutrientes, sino también de medicamentos.
Un transportador no está abierto simultáneamente a los entornos extracelular e intracelular. Su compuerta interna o externa está abierta. Por el contrario, un canal puede estar abierto a ambos entornos al mismo tiempo, lo que permite que las moléculas se difundan sin interrupción. Los transportadores tienen sitios de unión, pero los poros y canales no. [5] [6] [7] Cuando se abre un canal, millones de iones pueden atravesar la membrana por segundo, pero solo entre 100 y 1000 moléculas pasan típicamente a través de una molécula transportadora al mismo tiempo. [8] Cada proteína transportadora está diseñada para reconocer solo una sustancia o un grupo de sustancias muy similares. La investigación ha correlacionado defectos en proteínas transportadoras específicas con enfermedades específicas. [9]

El transporte activo es el movimiento de una sustancia a través de una membrana en contra de su gradiente de concentración. Esto suele ser para acumular altas concentraciones de moléculas que una célula necesita, como glucosa o aminoácidos. Si el proceso utiliza energía química, como el trifosfato de adenosina (ATP), se denomina transporte activo primario . Las proteínas de transporte de membrana que son impulsadas directamente por la hidrólisis de ATP se denominan bombas ATPasa . [10] Este tipo de bombas dirigen directamente la hidrólisis exergónica de ATP al movimiento desfavorable de moléculas en contra de su gradiente de concentración. Algunos ejemplos de bombas ATPasa son las ATPasas de tipo P , las ATPasas de tipo V , las ATPasas de tipo F y las casetes de unión ABC . [ cita requerida ]
El transporte activo secundario implica el uso de un gradiente electroquímico y no utiliza energía producida en la célula. [11] El transporte activo secundario utiliza comúnmente tipos de proteínas transportadoras, típicamente simportadores y antiportadores . Las proteínas simportadoras acoplan el transporte de una molécula a favor de su gradiente de concentración al transporte de otra molécula en contra de su gradiente de concentración, y ambas moléculas difunden en la misma dirección . Las proteínas antiportadoras transportan una molécula a favor de su gradiente de concentración para transportar otra molécula en contra de su gradiente de concentración, pero las moléculas difunden en direcciones opuestas . Como los simportadores y antiportadores están involucrados en el acoplamiento del transporte de dos moléculas, comúnmente se los conoce como cotransportadores . A diferencia de las proteínas de canal que solo transportan sustancias a través de las membranas de forma pasiva, las proteínas transportadoras pueden transportar iones y moléculas de forma pasiva a través de la difusión facilitada o mediante transporte activo secundario. [12] Se requiere una proteína transportadora para mover partículas de áreas de baja concentración a áreas de alta concentración. Estas proteínas transportadoras tienen receptores que se unen a una molécula específica (sustrato) que necesita transporte. La molécula o ion que se va a transportar (el sustrato) debe primero unirse a un sitio de unión en la molécula portadora, con una cierta afinidad de unión. Después de la unión, y mientras el sitio de unión está orientado en la misma dirección, el portador capturará u ocluirá (tomará y retendrá) el sustrato dentro de su estructura molecular y provocará una translocación interna de modo que la abertura en la proteína ahora esté orientada hacia el otro lado de la membrana plasmática. [13] El sustrato de la proteína portadora se libera en ese sitio, de acuerdo con su afinidad de unión allí. [ cita requerida ]
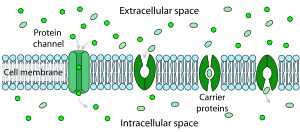
La difusión facilitada es el paso de moléculas o iones a través de una membrana biológica mediante proteínas transportadoras específicas y no requiere aporte de energía. La difusión facilitada se utiliza especialmente en el caso de moléculas polares grandes e iones cargados; una vez que dichos iones se disuelven en agua, no pueden difundir libremente a través de las membranas celulares debido a la naturaleza hidrofóbica de las colas de ácidos grasos de los fosfolípidos que forman las bicapas. El tipo de proteínas transportadoras utilizadas en la difusión facilitada es ligeramente diferente de las utilizadas en el transporte activo. Siguen siendo proteínas transportadoras transmembrana, pero se trata de canales transmembrana controlados, lo que significa que no se translocan internamente ni requieren ATP para funcionar. El sustrato se toma en un lado del transportador controlado y, sin utilizar ATP, el sustrato se libera en la célula. La difusión facilitada no requiere el uso de ATP, ya que la difusión facilitada, al igual que la difusión simple, transporta moléculas o iones a lo largo de su gradiente de concentración. [14]
La ósmosis es la difusión pasiva de agua a través de una membrana celular desde un área de alta concentración a un área de baja concentración. Dado que la ósmosis es un proceso pasivo, como la difusión facilitada y la difusión simple, no requiere el uso de ATP. La ósmosis es importante para regular el equilibrio de agua y sal dentro de las células, por lo que juega un papel crítico en el mantenimiento de la homeostasis. [15] Las acuaporinas son proteínas integrales de membrana que permiten el paso rápido de agua y glicerol a través de las membranas. Los monómeros de acuaporina constan de seis dominios de hélice alfa transmembrana y estos monómeros pueden ensamblarse para formar las proteínas de acuaporina. Como cuatro de estos monómeros se unen para formar la proteína acuaporina, se conoce como homotetrámero , lo que significa que está formado por cuatro subunidades idénticas. [16] [17] Todas las acuaporinas son proteínas integrales de membrana tetraméricas, y el agua pasa a través de cada canal de monómero individual en lugar de entre los cuatro canales. Dado que las acuaporinas son canales transmembrana para la difusión del agua, los canales que forman la acuaporina suelen estar revestidos con cadenas laterales hidrófilas para permitir que el agua pase a través de ellos.
El transporte inverso , o inversión del transportador , es un fenómeno en el que los sustratos de una proteína de transporte de membrana se mueven en la dirección opuesta a la de su movimiento típico por el transportador. [18] [19] [20] [21] [22] La inversión del transportador ocurre típicamente cuando una proteína de transporte de membrana es fosforilada por una proteína quinasa particular , que es una enzima que agrega un grupo fosfato a las proteínas. [18] [19]
(Agrupado por categorías de la base de datos de clasificación de transportadores )
La difusión facilitada ocurre dentro y fuera de la membrana celular a través de canales/poros y transportadores.
Nota:
Los canales se encuentran en estado abierto o cerrado. Cuando un canal se abre con un ligero cambio conformacional, queda abierto a ambos entornos simultáneamente (extracelular e intracelular).

Los poros están continuamente abiertos a ambos ambientes, porque no sufren cambios conformacionales. Están siempre abiertos y activos.
También llamadas proteínas transportadoras o transportadoras secundarias.


Los translocadores de grupo proporcionan un mecanismo especial para la fosforilación de azúcares a medida que son transportados hacia las bacterias (translocación del grupo PEP).
Los transportadores transmembrana de electrones en la membrana incluyen transportadores de dos electrones, como las oxidorreductasas de enlaces disulfuro (DsbB y DsbD en E. coli), así como transportadores de un electrón, como la NADPH oxidasa. A menudo, estas proteínas redox no se consideran proteínas de transporte.
Cada proteína transportadora, especialmente dentro de la misma membrana celular, es específica de un tipo o familia de moléculas. GLUT1 es una proteína transportadora con nombre que se encuentra en casi todas las membranas celulares animales y que transporta glucosa a través de la bicapa. Esta proteína es un uniportador , lo que significa que transporta glucosa a lo largo de su concentración en una dirección singular. Es una proteína transportadora de membrana integral con un interior hidrófilo, lo que le permite unirse a la glucosa. Como GLUT 1 es un tipo de proteína transportadora, sufrirá un cambio conformacional para permitir que la glucosa ingrese al otro lado de la membrana plasmática. [23] GLUT 1 se encuentra comúnmente en las membranas de los glóbulos rojos de los mamíferos. [24]
Si bien existen muchos ejemplos de canales dentro del cuerpo humano, dos de los más notables son los canales de sodio y potasio. Los canales de potasio suelen estar involucrados en el transporte de iones de potasio a través de la membrana celular hacia el exterior de la célula, lo que ayuda a mantener el potencial de membrana negativo de las células. Como hay más canales de potasio que canales de sodio, fluye más potasio fuera de la célula que sodio hacia adentro, de ahí el motivo por el cual el potencial de membrana es negativo. Los canales de sodio suelen estar involucrados en el transporte de iones de sodio a través de la membrana celular hacia adentro de la célula. Estos canales se asocian comúnmente con neuronas excitables, ya que una afluencia de sodio puede desencadenar la despolarización, que a su vez propaga un potencial de acción. [25] Como estas proteínas son tipos de proteínas de canal, no experimentan un cambio de conformación después de unirse a sus respectivos sustratos.
Otras proteínas transportadoras específicas también ayudan al funcionamiento del organismo de maneras importantes. Los citocromos funcionan en la cadena de transporte de electrones como proteínas transportadoras de electrones. [11]
Varias enfermedades hereditarias implican defectos en las proteínas transportadoras de una sustancia o grupo de células en particular. La cisteinuria (cisteína en la orina y la vejiga) es una enfermedad que implica proteínas transportadoras de cisteína defectuosas en las membranas celulares del riñón. Este sistema de transporte normalmente elimina la cisteína del líquido destinado a convertirse en orina y devuelve este aminoácido esencial a la sangre. Cuando este transportador funciona mal, grandes cantidades de cisteína permanecen en la orina, donde es relativamente insoluble y tiende a precipitarse. Esta es una de las causas de los cálculos urinarios. [26] Se ha demostrado que algunas proteínas transportadoras de vitaminas están sobreexpresadas en pacientes con enfermedades malignas. Por ejemplo, se ha demostrado que los niveles de proteína transportadora de riboflavina (RCP) están significativamente elevados en personas con cáncer de mama . [27]
Anderle, P., Barbacioru, C., Bussey, K., Dai, Z., Huang, Y., Papp, A., Reinhold, W., Sadee, W., Shankavaram, U., y Weinstein, J. (2004). Transportadores y canales de membrana: papel del transportoma en la quimiosensibilidad y la quimiorresistencia al cáncer. Cancer Research, 54, 4294-4301.