La yodación de hidrazona es una reacción orgánica en la que una hidrazona se convierte en un yoduro de vinilo mediante la reacción del yodo y una base no nucleófila como DBU . [1] [2] Publicada por primera vez por Derek Barton en 1962, la reacción a veces se conoce como la reacción de Barton (aunque hay muchas reacciones de Barton diferentes) o, de manera más descriptiva, como el procedimiento de yoduro de vinilo de Barton .
La reacción tiene raíces anteriores con el descubrimiento de 1911 por Wieland y Roseeu de que la reacción de las hidrazonas con yodo solo (sin base) da como resultado el dímero de azina (estructura 2 en el esquema 1 ).
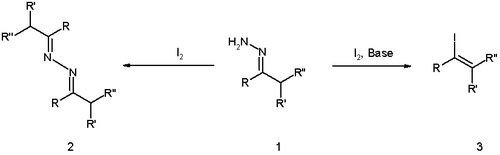
En la publicación original de Barton [3] la reacción se optimizó utilizando una base de guanidina fuerte , la adición inversa de la hidrazona a una solución de yodo y mediante la exclusión de agua.

Cuando el yodo como electrófilo se reemplaza por bromuros de selenilo aromáticos , se obtienen los seleniuros de vinilo correspondientes: [4]

El mecanismo de reacción propuesto en la publicación original de Barton se describe a continuación:

La hidrazona se oxida con yodo para formar un intermedio diazo . En el siguiente paso, el yodo reacciona como electrófilo; el desplazamiento del nitrógeno genera un ion yodocarbonio . Cuando el sitio de reacción no está impedido estéricamente, un segundo yoduro puede recombinarse para formar el diyoduro geminal ; de lo contrario, una reacción de eliminación conduce al yoduro de vinilo. Cuando hay agua presente, el producto de la reacción puede revertirse a la cetona .
Esta reacción está relacionada con la reacción de Shapiro .
Un ejemplo de este procedimiento es la reacción de 2,2,6-trimetilciclohexanona a la hidrazona mediante reacción con hidrazina y trietilamina en etanol a reflujo seguida de la reacción de la hidrazona con yodo en presencia de 2-terc-butil-1,1,3,3-tetrametilguanidina (más barata que DBU) en éter dietílico a temperatura ambiente . [5] Otro ejemplo se puede encontrar en la síntesis total de Taxol de Danishefsky .
En un estudio [6] se intenta atrapar cualquier intermedio reactivo de esta reacción con un alqueno interno . Cuando la hidrazona 1 en el esquema 5 se hace reaccionar con yodo y trietilamina en tolueno , el producto de reacción esperado no es el diyoduro 10 a través de la ruta B en un mecanismo de radicales libres . Secuencia de reacción que comienza en 1 : reacción de adición de halógeno al intermedio de diyoduro 2 seguida de una reacción de eliminación con pérdida de yoduro de hidrógeno a 3. En la ruta B, otro equivalente de yodo reacciona con el doble enlace azo seguido de la pérdida de HI y la formación de 6. El enlace de nitrógeno a yodo es débil y la homólisis da el radical libre de nitrógeno 7. La pérdida de nitrógeno da como resultado especies radicales 8. La posición del radical se transfiere al alqueno en 9 que luego se recombina con yoduro a 10 . Obsérvese que, en ausencia del alqueno 8 , éste aceptaría un radical yoduro y, por lo tanto, el diyoduro geminal perdería HI para formar el yoduro de vinilo. El proceso real que se lleva a cabo es el camino A, con la eliminación de HI al compuesto diazo 4 , seguida de una cicloadición 1,3-dipolar de diazoalcano a la pirazolina 5 con un rendimiento del 85 %.
