El potencial evocado somatosensorial ( PES o PESS ) es la actividad eléctrica del cerebro que resulta de la estimulación del tacto. Las pruebas de PES miden esa actividad y son un medio útil y no invasivo para evaluar el funcionamiento del sistema somatosensorial . Al combinar registros de PES en diferentes niveles de las vías somatosensoriales, es posible evaluar la transmisión de la descarga aferente desde la periferia hasta la corteza. Los componentes de los PES incluyen una serie de desviaciones positivas y negativas que pueden ser provocadas por prácticamente cualquier estímulo sensorial. Por ejemplo, los PES pueden obtenerse en respuesta a un breve impacto mecánico en la punta del dedo o a bocanadas de aire. [1] Sin embargo, los PES se provocan más comúnmente mediante estimulación eléctrica transcutánea bipolar aplicada sobre la piel a lo largo de la trayectoria de los nervios periféricos de la extremidad superior (p. ej., el nervio mediano) o la extremidad inferior (p. ej., el nervio tibial posterior), y luego se registran desde el cuero cabelludo. [2] En general, los estímulos somatosensoriales evocan componentes corticales tempranos (N25, P60, N80), generados en la corteza somatosensorial primaria contralateral (S1), relacionados con el procesamiento de los atributos del estímulo físico. Aproximadamente 100 ms después de la aplicación del estímulo, se activan regiones corticales adicionales, como la corteza somatosensorial secundaria (S2) y las cortezas parietal y frontal posterior , marcadas por un P100 parietal y un N140 frontal bilateral. Los SEP se utilizan rutinariamente en neurología hoy en día para confirmar y localizar anomalías sensoriales, identificar lesiones silenciosas y monitorear cambios durante procedimientos quirúrgicos. [3]
La historia moderna de los potenciales evocados se inició con las grabaciones de George Dawson en 1947 de las respuestas corticales somatosensoriales en pacientes con mioclono , una afección neurológica caracterizada por contracciones abruptas, involuntarias y espasmódicas de un músculo o grupo muscular. Debido a su amplitud relativamente grande y baja frecuencia compatible con una baja tasa de muestreo de conversión A/D, los potenciales evocados corticales fueron los primeros estudiados en sujetos y pacientes normales. [2] En la década de 1970 y principios de la de 1980 se identificaron los potenciales espinales y subcorticales (de campo lejano). Aunque los orígenes y mecanismos de los potenciales evocados de campo lejano aún se debaten en la literatura, las correlaciones entre las formas de onda anormales, el sitio de la lesión y las observaciones clínicas están bastante bien establecidas. Sin embargo, los avances más recientes se produjeron mediante grabaciones multicanal de potenciales evocados junto con el modelado de la fuente y la localización de la fuente en imágenes 3D del volumen cerebral proporcionadas por imágenes por resonancia magnética (IRM).
El modelado de las fuentes a partir de la distribución del campo da como resultado modelos de activación cerebral que pueden diferir sustancialmente de las observaciones de las correlaciones clínicas entre la forma de onda anormal y el sitio de la lesión. El enfoque basado en correlaciones clínicas respalda la idea de un único generador para cada componente de la SEP, lo que es adecuado para las respuestas que reflejan las fibras de activación secuencial y los relés sinápticos de las vías somatosensoriales. Por el contrario, el modelado de fuentes sugiere que la distribución del campo evocado en un momento dado puede ser el resultado de actividades de múltiples fuentes distribuidas que se superponen en el tiempo. Este modelo se ajusta mejor a la activación paralela y los controles de retroalimentación que caracterizan el procesamiento de las entradas somatosensoriales a nivel cortical. [2]
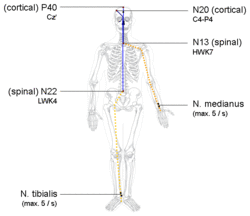
Al registrar los PSE, generalmente se intenta estudiar los PSE periféricos, espinales, del tronco encefálico y corticales tempranos durante la misma ejecución. Los electrodos colocados en el cuero cabelludo captan tanto los PSE generados en la corteza y las fibras talamocorticales (que se captan como respuestas de campo cercano ubicadas en áreas restringidas) como las positividades de campo lejano que reflejan la actividad evocada generada en las fibras somatosensoriales periféricas, espinales y del tronco encefálico .
La literatura está llena de discusiones sobre el sitio más apropiado para el electrodo de referencia para registrar cada uno de los componentes. Considerando la distribución del campo, la condición óptima de registro es en teoría aquella en la que la referencia no está influenciada por la actividad en estudio. La mayoría de los potenciales de campo lejano están ampliamente distribuidos sobre el cuero cabelludo. En consecuencia, alcanzan su amplitud máxima cuando el electrodo de referencia no es cefálico. Una referencia no cefálica común a todos los canales es adecuada para todos los registros de campo cercano. Un tema relevante es que el nivel de ruido fisiológico eléctrico (electrocardiograma, electromiograma, etc.) aumenta con la distancia entre los electrodos activo y de referencia en montajes de referencia no cefálicos. Los montajes de rutina de cuatro canales propuestos en las pautas de la Federación Internacional de Neurofisiología Clínica (IFCN) exploran la descarga periférica aferente, las respuestas espinales segmentarias a nivel del cuello y la columna lumbar, así como los PSE de campo lejano subcorticales y corticales tempranos, utilizando electrodos de cuero cabelludo colocados en las regiones parietal y frontal para los PSE de miembros superiores y en el vértice para los PSE de miembros inferiores. [2]
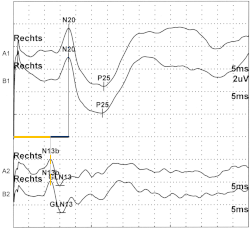
El nervio mediano comienza con la aplicación de un estímulo eléctrico a ese nervio en la muñeca. Se aplica un pulso eléctrico de onda cuadrada de 100 a 300 microsegundos con intensidades lo suficientemente fuertes como para provocar una contracción del pulgar de 1 a 2 cm. Tras la aplicación de dicho estímulo, las descargas de acción nerviosa recorren las fibras sensoriales y las fibras motoras hasta el hombro, produciendo un pico al entrar. Este pico se conoce formalmente como N9. En el curso de la conducción, las fibras sensoriales atraviesan las raíces cervicales y entran en la médula cervical. La vía del nervio mediano se une entonces a las columnas posteriores, enviando ramas colaterales para hacer sinapsis en la médula cervical media. Esta actividad de la médula cervical media da lugar a un pico conocido como N13. El N13 se mide mejor sobre la quinta espina cervical. La conducción posterior en las columnas posteriores pasa a través de la sinapsis en la unión cervicomedular y entra en la decusación lemniscal. A este nivel se genera un pico P14 del cuero cabelludo. A medida que la conducción continúa por el lemnisco medial hasta el mesencéfalo superior y el tálamo, se detecta un pico negativo en el cuero cabelludo, el N18. Después de hacer sinapsis en el tálamo y atravesar la cápsula interna , se registra el N20 sobre la corteza somatosensorial contralateral a la muñeca estimulada, lo que corresponde a la llegada de los impulsos nerviosos a la región somatosensorial primaria. [3]
La estimulación del nervio tibial posterior en el tobillo da lugar a una serie similar de picos posteriores. Se puede detectar un potencial N8 sobre el nervio tibial posterior en la rodilla. Se puede detectar un potencial N22 sobre la columna lumbar superior , que corresponde a la actividad colateral a medida que las fibras sensoriales hacen sinapsis en la médula espinal lumbar. Más rostralmente, se puede detectar ocasionalmente un potencial cervical sobre la columna cervical media o superior . Finalmente, se observa un potencial P37 en el cuero cabelludo sobre el cuero cabelludo de la línea media lateral al plano medio sagital, pero ipsilateral a la pierna estimulada. [3]
Los efectos de la edad en las latencias de los PSE reflejan principalmente una ralentización de la conducción en los nervios periféricos evidenciada por el aumento del componente N9 después de la estimulación del nervio mediano. También se han descrito tiempos de conducción central más cortos (CCT, el tiempo de tránsito de la descarga ascendente en los segmentos centrales de las vías somatosensoriales) en mujeres en comparación con los hombres, y también se sabe que las velocidades de conducción se ven afectadas por los cambios en la temperatura de las extremidades. Siempre se ha asumido que los PSE corticales que alcanzan su punto máximo antes de los 50 ms después de la estimulación de la extremidad superior no se ven afectados significativamente por los procesos cognitivos. Sin embargo, Desmedt et al. (1983) [4] identificaron un potencial P40 en respuesta a estímulos objetivo en una tarea de bolas extrañas , lo que sugiere que los procesos relacionados con la atención podrían afectar a los PSE corticales tempranos. Finalmente, se han descrito algunos cambios en la amplitud, la forma de onda y la latencia del N20 parietal durante el sueño natural en sujetos normales. [2]
Los SEP del nervio tibial medio y posterior se utilizan en una variedad de entornos clínicos. Pueden detectar, localizar y cuantificar interrupciones focales a lo largo de las vías somatosensoriales, que pueden deberse a una serie de problemas neurológicos focales, incluidos traumatismos, compresión, esclerosis múltiple , tumores u otras lesiones focales. Los SEP también son sensibles a la atenuación cortical debida a trastornos difusos del sistema nervioso central (SNC). Esto se observa en una variedad de trastornos neurodegenerativos y problemas metabólicos como la deficiencia de vitamina B12 . Cuando un paciente sufre deterioro sensorial y cuando la localización clínica del deterioro sensorial no está clara, los SEP pueden ser útiles para distinguir si el deterioro sensorial se debe a problemas del SNC en lugar de problemas del sistema nervioso periférico. El SEP del nervio mediano también es útil para predecir secuelas neurológicas después de un paro cardíaco : si el N20 cortical y los componentes posteriores están completamente ausentes 24 horas o más después del paro cardíaco, esencialmente todos los pacientes mueren o tienen secuelas neurológicas vegetativas. [3]
En la última década, la utilidad clínica de los PSE ha llegado al quirófano, permitiendo la monitorización intraoperatoria del SNC y, por tanto, salvaguardando las estructuras del SNC durante cirugías de alto riesgo. La monitorización continua de los PSE puede advertir al cirujano y acelerar la intervención antes de que el deterioro se vuelva permanente. [5] La prueba con PSE del nervio mediano se utiliza para identificar la corteza sensorial y motora durante las craneotomías y para monitorizar la cirugía a nivel cervical medio o cervical superior. La monitorización de los PSE del nervio tibial posterior se utiliza ampliamente para monitorizar la médula espinal durante los procedimientos de escoliosis y otras intervenciones quirúrgicas en las que la médula espinal corre el riesgo de sufrir daños. [3] El registro de los picos generados intracranealmente en el campo lejano puede facilitar la monitorización incluso cuando los picos corticales primarios están deteriorados debido a los agentes anestésicos. Con el tiempo, la prueba y la monitorización de los PSE en cirugía se han convertido en técnicas estándar ampliamente utilizadas para reducir el riesgo de problemas neurológicos posoperatorios para el paciente. La monitorización continua de los PSE puede advertir al cirujano sobre un posible daño a la médula espinal, lo que puede acelerar la intervención antes de que el deterioro se vuelva permanente. En general, los SEP pueden cumplir una variedad de objetivos clínicos específicos, entre ellos:
Además del ámbito clínico, los SEP han demostrado ser útiles en distintos paradigmas experimentales. Schubert et al. (2006) [6] utilizaron SEP para investigar el procesamiento diferencial de estímulos somatosensoriales percibidos conscientemente frente a no percibidos. Los autores utilizaron un paradigma de "extinción" para examinar la conexión entre la activación de S1 y la conciencia somatosensorial, y observaron que los SEP tempranos (P60, N80), generados en el S1 contralateral, eran independientes de la percepción del estímulo. Por el contrario, se observaron mejoras de amplitud para P100 y N140 para estímulos percibidos conscientemente. Los autores concluyeron que la activación temprana de S1 no es suficiente para justificar la percepción consciente del estímulo. El procesamiento consciente del estímulo difiere significativamente del procesamiento inconsciente a partir de unos 100 ms después de la presentación del estímulo cuando la señal se procesa en las cortezas parietal y frontal, regiones cerebrales cruciales para el acceso del estímulo a la percepción consciente. En otro estudio, Iwadate et al. (2005) analizaron [7] la relación entre el ejercicio físico y el procesamiento somatosensorial utilizando SEP. El estudio comparó los SEP en deportistas (jugadores de fútbol) y no deportistas, utilizando dos tareas extrañas después de una estimulación somatosensorial separada en el nervio mediano y en el nervio tibial. En el grupo de deportistas, las amplitudes de N140 fueron mayores durante las tareas de miembros superiores e inferiores en comparación con los no deportistas. Los autores concluyeron que los cambios plásticos en el procesamiento somatosensorial podrían inducirse mediante la realización de ejercicios físicos que requieren atención y movimientos hábiles.