
El polietileno o polietileno (abreviado PE ; nombre IUPAC polietileno o poli(metileno) ) es el plástico más comúnmente producido . [7] Es un polímero , utilizado principalmente para embalajes ( bolsas de plástico , películas de plástico , geomembranas y contenedores que incluyen botellas , vasos , frascos , etc.). A partir de 2017 [update], se producen anualmente más de 100 millones de toneladas de resinas de polietileno , lo que representa el 34% del mercado total de plásticos. [8] [9]
Se conocen muchos tipos de polietileno, la mayoría de los cuales tienen la fórmula química (C 2 H 4 ) n . El PE suele ser una mezcla de polímeros similares de etileno , con varios valores de n . Puede ser de baja o alta densidad y muchas variaciones de los mismos. Sus propiedades se pueden modificar aún más mediante reticulación o copolimerización. Todas las formas son no tóxicas y químicamente resistentes, lo que contribuye a la popularidad del polietileno como plástico de usos múltiples. Sin embargo, la resiliencia química del polietileno también lo convierte en un contaminante de larga duración y resistente a la descomposición cuando se desecha de forma inadecuada. [10] Al ser un hidrocarburo , el polietileno es incoloro a opaco (sin impurezas ni colorantes) y combustible. [11]
El polietileno fue sintetizado por primera vez por el químico alemán Hans von Pechmann , quien lo preparó por accidente en 1898 mientras investigaba el diazometano . [12] [a] [13] [b] Cuando sus colegas Eugen Bamberger y Friedrich Tschirner caracterizaron la sustancia blanca y cerosa que había creado, reconocieron que contenía largas cadenas de −CH 2 − y la denominaron polimetileno . [14]

La primera síntesis industrialmente práctica de polietileno (el diazometano es una sustancia notoriamente inestable que generalmente se evita en las síntesis industriales) fue descubierta nuevamente por accidente en 1933 por Eric Fawcett y Reginald Gibson en las instalaciones de Imperial Chemical Industries (ICI) en Northwich , Inglaterra . [15] Al aplicar una presión extremadamente alta (varios cientos de atmósferas ) a una mezcla de etileno y benzaldehído , nuevamente produjeron un material blanco y ceroso. Debido a que la reacción se había iniciado por contaminación de oxígeno traza en su aparato, el experimento fue difícil de reproducir al principio. No fue hasta 1935 que otro químico de ICI, Michael Perrin , desarrolló este accidente en una síntesis reproducible de alta presión para polietileno que se convirtió en la base para la producción industrial de polietileno de baja densidad ( LDPE ) a partir de 1939. Debido a que se descubrió que el polietileno tenía propiedades de pérdida muy baja en ondas de radio de frecuencia muy alta, la distribución comercial en Gran Bretaña se suspendió al estallar la Segunda Guerra Mundial, se impuso el secreto y el nuevo proceso se utilizó para producir aislamiento para cables coaxiales UHF y SHF de equipos de radar . Durante la Segunda Guerra Mundial, se realizó más investigación sobre el proceso ICI y en 1944, DuPont en Sabine River, Texas, y Union Carbide Corporation en South Charleston, West Virginia, comenzaron la producción comercial a gran escala bajo licencia de ICI. [16] [17]
El avance histórico en la producción comercial de polietileno comenzó con el desarrollo de catalizadores que promovían la polimerización a temperaturas y presiones suaves. El primero de ellos fue un catalizador basado en trióxido de cromo descubierto en 1951 por Robert Banks y J. Paul Hogan en Phillips Petroleum . [18] En 1953, el químico alemán Karl Ziegler desarrolló un sistema catalítico basado en haluros de titanio y compuestos de organoaluminio que funcionaban en condiciones incluso más suaves que el catalizador de Phillips. Sin embargo, el catalizador de Phillips es menos costoso y más fácil de trabajar, y ambos métodos se utilizan ampliamente en la industria. A fines de la década de 1950, tanto el catalizador de tipo Phillips como el de Ziegler se usaban para la producción de polietileno de alta densidad (HDPE). En la década de 1970, el sistema de Ziegler se mejoró con la incorporación de cloruro de magnesio . Los sistemas catalíticos basados en catalizadores solubles, los metalocenos , fueron descritos en 1976 por Walter Kaminsky y Hansjörg Sinn. Las familias de catalizadores basados en Ziegler y metalocenos han demostrado ser muy flexibles en la copolimerización de etileno con otras olefinas y se han convertido en la base de la amplia gama de resinas de polietileno disponibles en la actualidad, incluidos el polietileno de muy baja densidad y el polietileno lineal de baja densidad . Dichas resinas, en forma de fibras de UHMWPE , han comenzado (a partir de 2005) a reemplazar a las aramidas en muchas aplicaciones de alta resistencia.
Las propiedades del polietileno dependen en gran medida del tipo. El peso molecular, la reticulación y la presencia de comonómeros afectan en gran medida a sus propiedades. Es por esta relación estructura-propiedad que se ha invertido un intenso esfuerzo en diversos tipos de PE. [7] [19] El LDPE es más blando y más transparente que el HDPE. Para el polietileno de densidad media y alta, el punto de fusión está típicamente en el rango de 120 a 130 °C (248 a 266 °F). El punto de fusión para el polietileno de baja densidad comercial promedio es típicamente de 105 a 115 °C (221 a 239 °F). Estas temperaturas varían mucho con el tipo de polietileno, pero se informa que el límite superior teórico de fusión del polietileno es de 144 a 146 °C (291 a 295 °F). La combustión ocurre típicamente por encima de los 349 °C (660 °F).
La mayoría de los grados de LDPE , MDPE y HDPE tienen una excelente resistencia química, lo que significa que no son atacados por ácidos fuertes o bases fuertes y son resistentes a oxidantes suaves y agentes reductores. Las muestras cristalinas no se disuelven a temperatura ambiente. El polietileno (excepto el polietileno reticulado) generalmente se puede disolver a temperaturas elevadas en hidrocarburos aromáticos como tolueno o xileno , o en solventes clorados como tricloroetano o triclorobenceno . [7]
El polietileno prácticamente no absorbe agua ; su permeabilidad a los gases y al vapor de agua (solo a los gases polares) es menor que la de la mayoría de los plásticos. El oxígeno , el dióxido de carbono y los aromas , en cambio, sí lo pueden dejar pasar fácilmente.
El polietileno arde lentamente con una llama azul con una punta amarilla y desprende un olor a parafina (similar a la llama de una vela ). El material sigue ardiendo al retirar la fuente de la llama y produce un goteo. [20]
El polietileno no se puede imprimir ni unir con adhesivos sin un tratamiento previo. Las uniones de alta resistencia se logran fácilmente con soldadura de plástico .
El polietileno es un buen aislante eléctrico . Ofrece una buena resistencia a la arborización eléctrica ; sin embargo, se carga electrostáticamente con facilidad (lo que se puede reducir mediante la adición de grafito , negro de carbono o agentes antiestáticos ). Cuando está puro, la constante dieléctrica está en el rango de 2,2 a 2,4 dependiendo de la densidad [21] y la tangente de pérdida es muy baja, lo que lo convierte en un buen dieléctrico para construir condensadores . Por la misma razón, se utiliza comúnmente como material aislante para cables coaxiales y de par trenzado de alta frecuencia.
Dependiendo del historial térmico y el espesor de la película, el PE puede variar entre casi transparente , lechoso opaco y opaco . El LDPE tiene la mayor transparencia, el LLDPE ligeramente menos y el HDPE la menor. La transparencia se reduce por los cristalitos si son más grandes que la longitud de onda de la luz visible. [22]
El ingrediente o monómero es etileno ( nombre IUPAC eteno), un hidrocarburo gaseoso con la fórmula C 2 H 4 , que puede verse como un par de grupos metileno (− CH
2−) conectados entre sí. Las especificaciones típicas para la pureza del PE son <5 ppm para el contenido de agua, oxígeno y otros alquenos . Los contaminantes aceptables incluyen N 2 , etano (precursor común del etileno) y metano. El etileno generalmente se produce a partir de fuentes petroquímicas, pero también se genera por deshidratación de etanol. [7]
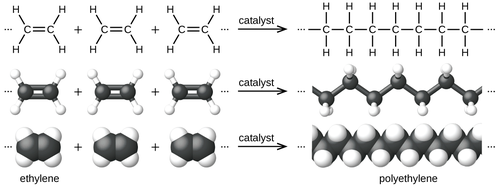
La polimerización de etileno a polietileno se describe mediante la siguiente ecuación química :
El etileno es una molécula estable que se polimeriza únicamente al entrar en contacto con catalizadores. La conversión es altamente exotérmica . La polimerización por coordinación es la tecnología más extendida, lo que significa que se utilizan cloruros u óxidos metálicos. Los catalizadores más comunes consisten en cloruro de titanio (III) , los llamados catalizadores Ziegler-Natta . Otro catalizador común es el catalizador Phillips , preparado mediante la deposición de óxido de cromo (VI) sobre sílice. [7] El polietileno se puede producir mediante polimerización radical , pero esta ruta tiene una utilidad limitada y normalmente requiere aparatos de alta presión.
Los métodos comúnmente utilizados para unir piezas de polietileno incluyen: [24]
Los adhesivos sensibles a la presión (PSA) son factibles si la química o la carga de la superficie se modifica con activación de plasma , tratamiento de llama o tratamiento de corona .
El polietileno se clasifica por su densidad y ramificación . Sus propiedades mecánicas dependen en gran medida de variables como la extensión y el tipo de ramificación, la estructura cristalina y el peso molecular . Existen varios tipos de polietileno:
En cuanto a volúmenes vendidos, los grados de polietileno más importantes son HDPE, LLDPE y LDPE.
.jpg/440px-Stainless_steel_and_ultra_high_molecular_weight_polythene_hip_replacement_(9672239334).jpg)
El UHMWPE es un polietileno con un peso molecular de millones, normalmente entre 3,5 y 7,5 millones de uma . [25] Su alto peso molecular lo convierte en un material muy resistente , pero da como resultado un empaquetamiento menos eficiente de las cadenas en la estructura cristalina, como lo evidencian las densidades inferiores a las del polietileno de alta densidad (por ejemplo, 0,930–0,935 g/cm3 ) . El UHMWPE se puede fabricar mediante cualquier tecnología de catalizador, aunque los catalizadores Ziegler son los más comunes. Debido a su excelente tenacidad y a su excelente resistencia al corte, al desgaste y a los productos químicos, el UHMWPE se utiliza en una amplia gama de aplicaciones. Estas incluyen piezas de máquinas de manipulación de latas y botellas , piezas móviles de telares, cojinetes, engranajes, articulaciones artificiales, protección de bordes en pistas de hielo, reemplazos de cables de acero en barcos y tablas de cortar de carniceros. Se utiliza comúnmente para la construcción de porciones articulares de implantes utilizados para reemplazos de cadera y rodilla . Como fibra , compite con la aramida en los chalecos antibalas .

El HDPE se define por una densidad mayor o igual a 0,941 g/cm 3 . El HDPE tiene un bajo grado de ramificación. Las moléculas, en su mayoría lineales, se compactan bien, por lo que las fuerzas intermoleculares son más fuertes que en los polímeros altamente ramificados. El HDPE se puede producir mediante catalizadores de cromo /sílice, catalizadores Ziegler-Natta o catalizadores de metaloceno ; al elegir los catalizadores y las condiciones de reacción, se puede controlar la pequeña cantidad de ramificación que ocurre. Estos catalizadores prefieren la formación de radicales libres en los extremos de las moléculas de polietileno en crecimiento. Hacen que los nuevos monómeros de etileno se agreguen a los extremos de las moléculas, en lugar de a lo largo del medio, lo que provoca el crecimiento de una cadena lineal.
El HDPE tiene una alta resistencia a la tracción. Se utiliza en productos y envases como jarras de leche, botellas de detergente, tarrinas de mantequilla, contenedores de basura y tuberías de agua .
El PEX es un polietileno de densidad media a alta que contiene enlaces cruzados introducidos en la estructura del polímero, lo que transforma el termoplástico en un termoendurecible . Se mejoran las propiedades de alta temperatura del polímero, se reduce su flujo y se mejora su resistencia química. El PEX se utiliza en algunos sistemas de plomería de agua potable porque los tubos hechos de este material se pueden expandir para encajar sobre una boquilla de metal y volverán lentamente a su forma original, formando una conexión permanente y hermética.
El MDPE se define por un rango de densidad de 0,926 a 0,940 g/cm 3 . El MDPE se puede producir con catalizadores de cromo/sílice, catalizadores Ziegler-Natta o catalizadores de metaloceno. El MDPE tiene buenas propiedades de resistencia a golpes y caídas. También es menos sensible a las muescas que el HDPE; la resistencia al agrietamiento por tensión es mejor que la del HDPE. El MDPE se utiliza normalmente en tuberías y accesorios de gas, sacos, películas retráctiles, películas de embalaje, bolsas de transporte y cierres de rosca.
El LLDPE se define por un rango de densidad de 0,915–0,925 g/cm 3 . El LLDPE es un polímero sustancialmente lineal con un número significativo de ramificaciones cortas, que se fabrica comúnmente por copolimerización de etileno con alfa-olefinas de cadena corta (por ejemplo, 1-buteno , 1-hexeno y 1-octeno ). El LLDPE tiene una mayor resistencia a la tracción que el LDPE y exhibe una mayor resistencia al impacto y a la perforación que el LDPE. Se pueden soplar películas de menor espesor (calibre), en comparación con el LDPE, con una mejor resistencia al agrietamiento por tensión ambiental , pero no son tan fáciles de procesar. El LLDPE se utiliza en embalajes, particularmente películas para bolsas y láminas. Se puede utilizar un espesor menor en comparación con el LDPE. Se utiliza para cubiertas de cables, juguetes, tapas, baldes, contenedores y tuberías. Si bien hay otras aplicaciones disponibles, el LLDPE se utiliza predominantemente en aplicaciones de película debido a su tenacidad, flexibilidad y relativa transparencia. Los ejemplos de productos varían desde películas agrícolas, film transparente y film de burbujas hasta películas multicapa y compuestas.
El LDPE se define por un rango de densidad de 0,910–0,940 g/cm 3 . El LDPE tiene un alto grado de ramificación de cadena corta y larga, lo que significa que las cadenas no se empaquetan bien en la estructura cristalina . Por lo tanto, tiene fuerzas intermoleculares menos fuertes ya que la atracción dipolo instantáneo-dipolo inducido es menor. Esto da como resultado una menor resistencia a la tracción y una mayor ductilidad . El LDPE se crea por polimerización por radicales libres . El alto grado de ramificación con cadenas largas le da al LDPE fundido propiedades de flujo únicas y deseables. El LDPE se utiliza tanto para contenedores rígidos como para aplicaciones de película plástica, como bolsas de plástico y envoltura de película.
El proceso de polimerización radical que se utiliza para fabricar LDPE no incluye un catalizador que "supervise" los sitios radicales en las cadenas de PE en crecimiento. (En la síntesis de HDPE, los sitios radicales están en los extremos de las cadenas de PE, porque el catalizador estabiliza su formación en los extremos). Los radicales secundarios (en el medio de una cadena) son más estables que los radicales primarios (al final de la cadena), y los radicales terciarios (en un punto de ramificación) son aún más estables. Cada vez que se agrega un monómero de etileno, se crea un radical primario, pero a menudo estos se reorganizarán para formar radicales secundarios o terciarios más estables. La adición de monómeros de etileno a los sitios secundarios o terciarios crea ramificaciones.
El VLDPE se define por un rango de densidad de 0,880 a 0,915 g/cm 3 . El VLDPE es un polímero sustancialmente lineal con altos niveles de ramificaciones de cadena corta, que se obtiene comúnmente por copolimerización de etileno con alfa-olefinas de cadena corta (por ejemplo, 1-buteno, 1-hexeno y 1-octeno). El VLDPE se produce más comúnmente utilizando catalizadores de metaloceno debido a la mayor incorporación de comonómeros que exhiben estos catalizadores. Los VLDPE se utilizan para mangueras y tubos, bolsas de hielo y alimentos congelados, envases de alimentos y film estirable, así como modificadores de impacto cuando se mezclan con otros polímeros.
Gran parte de la investigación se ha centrado en la naturaleza y la distribución de las ramificaciones de cadena larga en el polietileno. En el HDPE, una cantidad relativamente pequeña de estas ramificaciones, quizás una de cada 100 o 1.000 ramificaciones por carbono de la cadena principal, puede afectar significativamente las propiedades reológicas del polímero.
Además de la copolimerización con alfa-olefinas, el etileno se puede copolimerizar con una amplia gama de otros monómeros y composiciones iónicas que crean radicales libres ionizados. Los ejemplos comunes incluyen acetato de vinilo (el producto resultante es copolímero de etileno-acetato de vinilo , o EVA, ampliamente utilizado en espumas para suelas de calzado deportivo) y una variedad de acrilatos . Las aplicaciones del copolímero acrílico incluyen embalajes y artículos deportivos, y superplastificantes , utilizados en la producción de cemento.
Las propiedades particulares del material "polietileno" dependen de su estructura molecular. El peso molecular y la cristalinidad son los factores más significativos; la cristalinidad a su vez depende del peso molecular y del grado de ramificación. Cuanto menos ramificadas estén las cadenas de polímero y cuanto menor sea el peso molecular, mayor será la cristalinidad del polietileno. La cristalinidad varía entre el 35% (PE-LD/PE-LLD) y el 80% (PE-HD). El polietileno tiene una densidad de 1,0 g/cm 3 en las regiones cristalinas y de 0,86 g/cm 3 en las regiones amorfas. Existe una relación casi lineal entre la densidad y la cristalinidad. [19]
El grado de ramificación de los diferentes tipos de polietileno se puede representar esquemáticamente de la siguiente manera: [19]
La figura muestra las cadenas principales, las ramificaciones de cadena corta y las ramificaciones de cadena lateral del polietileno. Las cadenas de polímero están representadas linealmente.
Las propiedades del polietileno dependen en gran medida del tipo y número de ramificaciones de la cadena. Las ramificaciones de la cadena dependen a su vez del proceso utilizado: ya sea el proceso de alta presión (solo PE-LD) o el proceso de baja presión (todos los demás grados de PE). El polietileno de baja densidad se produce mediante el proceso de alta presión por polimerización radical, con lo que se forman numerosas ramificaciones de cadena corta y de cadena larga. Las ramificaciones de cadena corta se forman mediante reacciones de transferencia de cadena intramolecular , siempre son ramificaciones de cadena de butilo o etilo porque la reacción se desarrolla según el siguiente mecanismo:


El uso generalizado del polietileno plantea posibles dificultades para la gestión de residuos , ya que no es fácilmente biodegradable. Desde 2008, Japón ha aumentado el reciclaje de plástico, pero todavía hay una gran cantidad de envoltorios de plástico que se desperdician. El reciclaje de plástico en Japón es un mercado potencial de 90 mil millones de dólares . [26]
Es posible convertir rápidamente el polietileno en hidrógeno y grafeno mediante calentamiento. La energía necesaria es mucho menor que la necesaria para producir hidrógeno mediante electrólisis. [27] [28]
Se han llevado a cabo varios experimentos con el objetivo de descubrir enzimas u organismos que degraden el polietileno. Varios plásticos (poliésteres, policarbonatos, poliamidas) se degradan por hidrólisis u oxidación con aire. En algunos casos, la degradación se ve incrementada por bacterias o diversos cócteles de enzimas. La situación es muy diferente en el caso de los polímeros cuya estructura principal consiste únicamente en enlaces CC. Estos polímeros incluyen polietileno, pero también polipropileno, poliestireno y acrilatos. En el mejor de los casos, estos polímeros se degradan muy lentamente, pero estos experimentos son difíciles porque los rendimientos y las velocidades son muy lentos. [29] Para complicar aún más la situación, incluso los éxitos preliminares son recibidos con entusiasmo por la prensa popular. [30] [31] [32] Algunos desafíos técnicos en esta área incluyen la imposibilidad de identificar las enzimas responsables de la degradación propuesta. Otro problema es que los organismos son incapaces de importar hidrocarburos de peso molecular superior a 500. [29]
Se afirma que las larvas de la polilla india de la harina metabolizan el polietileno, basándose en la observación de que las bolsas de plástico en la casa de un investigador tenían pequeños agujeros. Deduciendo que las larvas hambrientas deben haber digerido el plástico de alguna manera, él y su equipo analizaron sus bacterias intestinales y encontraron algunas que podrían usar el plástico como su única fuente de carbono. Las bacterias de los intestinos de las larvas de la polilla Plodia interpunctella no solo podían metabolizar el polietileno, sino que lo degradaron significativamente, reduciendo su resistencia a la tracción en un 50%, su masa en un 10% y los pesos moleculares de sus cadenas poliméricas en un 13%. [33] [34]
Se dice que la oruga de Galleria mellonella consume polietileno. La oruga puede digerirlo gracias a una combinación de su microbiota intestinal [35] y su saliva, que contiene enzimas que oxidan y despolimerizan el plástico. [36]
Cuando se expone a la radiación solar ambiental, el plástico produce trazas de dos gases de efecto invernadero , metano y etileno . El tipo de plástico que libera gases a mayor ritmo es el polietileno de baja densidad (LDPE). Debido a su baja densidad, se descompone más fácilmente con el tiempo, lo que genera áreas de superficie más grandes. Cuando se incuba en el aire, el LDPE emite gases a tasas ~2 veces y ~76 veces mayores en comparación con la incubación en agua para el metano y el etileno, respectivamente. Sin embargo, según las tasas medidas en el estudio, la producción de metano por parte de los plásticos es actualmente un componente insignificante del presupuesto global de metano. [37]
El polietileno puede modificarse durante la polimerización mediante comonómeros polares o no polares o, después de la polimerización, mediante reacciones análogas a los polímeros. Las reacciones análogas a los polímeros más comunes son las de reticulación , cloración y sulfocloración del polietileno .
En el proceso de baja presión se pueden añadir α-olefinas (por ejemplo, 1-buteno o 1-hexeno ), que se incorporan a la cadena polimérica durante la polimerización. Estos copolímeros introducen cadenas laterales cortas, por lo que se reduce la cristalinidad y la densidad . Como se ha explicado anteriormente, con ello se modifican las propiedades mecánicas y térmicas. En particular, de esta manera se produce PE-LLD.
El polietileno de metaloceno (PE-M) se prepara por medio de catalizadores de metaloceno , que generalmente incluyen copolímeros (p. ej., eteno/hexeno). El polietileno de metaloceno tiene una distribución de peso molecular relativamente estrecha , una tenacidad excepcionalmente alta, excelentes propiedades ópticas y un contenido de comonómero uniforme. Debido a la distribución de peso molecular estrecha, se comporta menos pseudoplástico (especialmente bajo velocidades de cizallamiento más altas). El polietileno de metaloceno tiene una baja proporción de componentes de bajo peso molecular (extraíbles) y una baja temperatura de soldadura y sellado. Por lo tanto, es particularmente adecuado para la industria alimentaria. [19] : 238 [38] : 19
El polietileno con una distribución de peso molecular multimodal se compone de varias fracciones de polímeros, que se mezclan de forma homogénea. Estos tipos de polietileno ofrecen una rigidez, tenacidad, resistencia, resistencia a la fisuración por tensión extremadamente altas y una mayor resistencia a la propagación de grietas. Se componen de proporciones iguales de fracciones de polímeros de mayor y menor peso molecular. Las unidades de menor peso molecular cristalizan más fácilmente y se relajan más rápido. Las fracciones de mayor peso molecular forman moléculas de enlace entre los cristalitos, lo que aumenta la tenacidad y la resistencia a la fisuración por tensión. El polietileno con una distribución de peso molecular multimodal se puede preparar en reactores de dos etapas, mediante catalizadores con dos centros activos sobre un soporte o mediante mezcla en extrusoras. [19] : 238
Los copolímeros de olefinas cíclicas se preparan mediante la copolimerización de eteno y cicloolefinas (normalmente norborneno ) producidas mediante el uso de catalizadores de metaloceno. Los polímeros resultantes son polímeros amorfos y particularmente transparentes y resistentes al calor. [19] : 239 [38] : 27
Los compuestos básicos utilizados como comonómeros polares son el alcohol vinílico ( Etenol , un alcohol insaturado), el ácido acrílico ( ácido propenoico , un ácido insaturado) y los ésteres que contienen uno de los dos compuestos.
El copolímero de etileno/alcohol vinílico (EVOH) es (formalmente) un copolímero de PE y alcohol vinílico (etenol), que se prepara mediante hidrólisis (parcial) del copolímero de etileno-acetato de vinilo (ya que el alcohol vinílico en sí no es estable). Sin embargo, normalmente, el EVOH tiene un contenido de comonómero más alto que el VAC que se utiliza habitualmente. [39] : 239
El EVOH se utiliza en películas multicapa para embalajes como capa de barrera (plástico de barrera). Como el EVOH es higroscópico (atrae el agua), absorbe agua del entorno, por lo que pierde su efecto de barrera. Por lo tanto, debe utilizarse como capa central rodeada de otros plásticos (como LDPE, PP, PA o PET). El EVOH también se utiliza como agente de recubrimiento contra la corrosión en farolas, postes de semáforos y paredes de protección acústica. [39] : 239
Los copolímeros de etileno y ácidos carboxílicos insaturados (como el ácido acrílico) se caracterizan por una buena adhesión a diversos materiales, por su resistencia al agrietamiento por tensión y por su alta flexibilidad. [40] Sin embargo, son más sensibles al calor y a la oxidación que los homopolímeros de etileno. Los copolímeros de etileno/ácido acrílico se utilizan como promotores de adhesión. [19]
Si en el polímero están presentes sales de un ácido carboxílico insaturado, se forman redes iónicas termorreversibles, llamadas ionómeros . Los ionómeros son termoplásticos muy transparentes que se caracterizan por una alta adhesión a los metales, una alta resistencia a la abrasión y una alta absorción de agua. [19]
Si se copolimerizan ésteres insaturados con etileno, la fracción alcohólica puede estar en la cadena principal del polímero (como es el caso del copolímero de etileno-acetato de vinilo) o la fracción ácida (por ejemplo, en el copolímero de etileno-acrilato de etilo). Los copolímeros de etileno-acetato de vinilo se preparan de manera similar al LD-PE mediante polimerización a alta presión. La proporción de comonómero tiene una influencia decisiva en el comportamiento del polímero.
La densidad disminuye hasta una proporción de comonómero del 10% debido a la formación de cristales alterados. Con proporciones más altas se acerca a la del acetato de polivinilo (1,17 g/cm 3 ). [39] : 235 Debido a la disminución de la cristalinidad, los copolímeros de etileno acetato de vinilo se vuelven más blandos a medida que aumenta el contenido de comonómero. Los grupos laterales polares cambian significativamente las propiedades químicas (en comparación con el polietileno): [19] : 224 la resistencia a la intemperie, la adhesividad y la soldabilidad aumentan con el contenido de comonómero, mientras que la resistencia química disminuye. También se modifican las propiedades mecánicas: la resistencia al agrietamiento por tensión y la tenacidad en frío aumentan, mientras que el límite elástico y la resistencia al calor disminuyen. Con una proporción muy alta de comonómeros (alrededor del 50%) se producen termoplásticos gomosos ( elastómeros termoplásticos ). [39] : 235
Los copolímeros de etileno-acrilato de etilo se comportan de manera similar a los copolímeros de etileno-acetato de vinilo. [19] : 240
Se hace una distinción básica entre reticulación de peróxido (PE-Xa), reticulación de silano (PE-Xb), reticulación por haz de electrones (PE-Xc) y reticulación azo (PE-Xd). [41]
Se muestran los métodos de reticulación con peróxido, silano e irradiación. En cada uno de ellos, se genera un radical en la cadena de polietileno (arriba en el centro), ya sea por radiación (h·ν) o por peróxidos (ROOR). Luego, dos cadenas de radicales pueden reticularse directamente (abajo a la izquierda) o indirectamente por compuestos de silano (abajo a la derecha).
El polietileno clorado (PE-C) es un material económico que tiene un contenido de cloro de entre el 34 y el 44 %. Se utiliza en mezclas con PVC porque el cloropolietileno blando y gomoso está incrustado en la matriz de PVC, lo que aumenta la resistencia al impacto . También aumenta la resistencia a la intemperie. Además, se utiliza para ablandar láminas de PVC, sin correr el riesgo de que se migraran los plastificantes. El polietileno clorado se puede reticular peroxidásicamente para formar un elastómero que se utiliza en la industria del caucho y los cables. [39] Cuando se añade polietileno clorado a otras poliolefinas, reduce la inflamabilidad. [19] : 245
El PE clorosulfonado (CSM) se utiliza como materia prima para el caucho sintético resistente al ozono . [44]
Braskem y Toyota Tsusho Corporation iniciaron actividades de comercialización conjuntas para producir polietileno a partir de caña de azúcar . Braskem construirá una nueva instalación en su unidad industrial existente en Triunfo, Rio Grande do Sul, Brasil, con una capacidad de producción anual de 200.000 toneladas cortas (180.000.000 kg), y producirá polietileno de alta y baja densidad a partir de bioetanol derivado de la caña de azúcar. [45]
El nombre polietileno proviene del ingrediente y no del compuesto químico resultante, que no contiene enlaces dobles. El nombre científico polietileno se deriva sistemáticamente del nombre científico del monómero. [46] [47] El monómero alqueno se convierte en un alcano largo, a veces muy largo, en el proceso de polimerización. [47] En ciertas circunstancias es útil utilizar una nomenclatura basada en la estructura; en tales casos, la IUPAC recomienda poli(metileno) (poli(metanodiilo) es una alternativa no preferida). [46] La diferencia en los nombres entre los dos sistemas se debe a la apertura del doble enlace del monómero durante la polimerización. [48] El nombre se abrevia a PE . De manera similar, polipropileno y poliestireno se abrevian a PP y PS, respectivamente. En el Reino Unido y la India, el polímero se llama comúnmente polietileno , del nombre comercial ICI , aunque esto no está reconocido científicamente.
[página 956]:
Eine theilweise – übrigens immer nur minimale – Umwandlung des Diazomethans in Stickstoff und Polymethylen vollzieht sich auch bei ganz andersartigen Reactionen; ...
[
Una conversión parcial (por cierto, siempre mínima) del diazometano en nitrógeno y polimetileno se produce también en reacciones muy diferentes; ...
]