La oxidación de Baeyer-Villiger es una reacción orgánica que forma un éster a partir de una cetona o una lactona a partir de una cetona cíclica, utilizando peroxiácidos o peróxidos como oxidante . [1] La reacción lleva el nombre de Adolf von Baeyer y Victor Villiger , quienes informaron por primera vez de la reacción en 1899. [1]

En el primer paso del mecanismo de reacción , el peroxiácido protona el oxígeno del grupo carbonilo . [1] Esto hace que el grupo carbonilo sea más susceptible a ser atacado por el peroxiácido. [1] A continuación, el peroxiácido ataca el carbono del grupo carbonilo formando lo que se conoce como intermedio de Criegee . [1] A través de un mecanismo concertado , uno de los sustituyentes del grupo cetona migra al oxígeno del grupo peróxido mientras que un ácido carboxílico sale. [1] Se cree que este paso de migración es el paso determinante de la tasa . [2] [3] Finalmente, la desprotonación del ion oxocarbenio produce el éster . [1]

Se cree que los productos de la oxidación de Baeyer-Villiger se controlan mediante efectos estereoelectrónicos tanto primarios como secundarios . [4] El principal efecto estereoelectrónico en la oxidación de Baeyer-Villiger se refiere a la necesidad de que el enlace oxígeno-oxígeno en el grupo peróxido sea antiperiplanar con respecto al grupo que migra. [4] [3] Esta orientación facilita la superposición óptima del orbital 𝛔 del grupo migratorio al orbital 𝛔* del grupo peróxido. [1] El efecto estereoelectrónico secundario se refiere a la necesidad de que el par solitario del oxígeno del grupo hidroxilo sea antiperiplanar con respecto al grupo migratorio. [4] Esto permite una superposición óptima del orbital no enlazante del oxígeno con el orbital 𝛔* del grupo migratorio. [5] Esta etapa de migración también está asistida (al menos in silico ) por dos o tres unidades de peroxiácido que permiten que el protón hidroxilo se desplace a su nueva posición. [6]
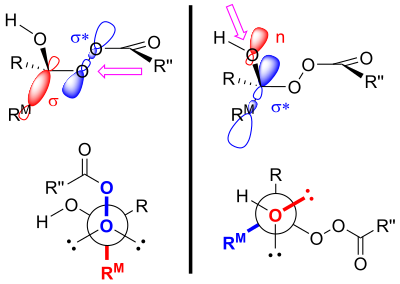
La capacidad migratoria se clasifica como terciaria > secundaria > arilica > primaria. [7] Los grupos alílicos son más propensos a migrar que los grupos alquilo primarios, pero menos que los grupos alquilo secundarios. [5] Los grupos aceptores de electrones en el sustituyente disminuyen la tasa de migración. [8] Hay dos explicaciones para esta tendencia en la capacidad migratoria. [9] Una explicación se basa en la acumulación de carga positiva en el estado de transición para la descomposición del intermedio Criegee (ilustrado por la estructura de resonancia de carbocatión del intermedio Criegee). [9] Teniendo en cuenta esta estructura, tiene sentido que el sustituyente que mejor pueda mantener la carga positiva tenga más probabilidades de migrar. [9] Cuanto mayor es el grado de sustitución, más estable es generalmente un carbocatión. [10] Por tanto, se observa la tendencia terciario > secundario > primario.

Otra explicación utiliza efectos estereoelectrónicos y argumentos estéricos. [11] Como se mencionó, el sustituyente que es antiperiplanar al grupo peróxido en el estado de transición migrará. [4] Este estado de transición tiene una interacción torpe entre el peroxiácido y el sustituyente no migratorio. [11] Si el grupo más voluminoso se coloca antiperiplanar al grupo peróxido, se reducirá la interacción torpe entre el sustituyente en el éster en formación y el grupo carbonilo del peroxiácido. [11] Por lo tanto, es el grupo más voluminoso el que preferirá ser antiperiplanar al grupo peróxido, mejorando su aptitud para la migración. [11]

El grupo migratorio en las cetonas acíclicas, normalmente, no es un grupo alquilo de primer grado. Sin embargo, se les puede persuadir para que migren con preferencia a los grupos 2° o 3° utilizando CF 3 CO 3 H o BF 3 + H 2 O 2 como reactivos. [12]
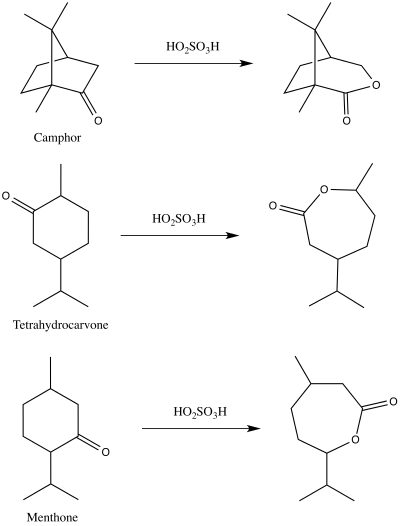
En 1899, Adolf Baeyer y Victor Villiger publicaron por primera vez una demostración de la reacción que ahora conocemos como oxidación de Baeyer-Villiger. [13] [14] Usaron ácido peroximonosulfúrico para producir las lactonas correspondientes a partir de alcanfor , mentona y tetrahidrocarvona. [14] [15]
Se sugirieron tres mecanismos de reacción de la oxidación de Baeyer-Villiger que parecían encajar con los resultados de la reacción observados. [16] Estos tres mecanismos de reacción realmente se pueden dividir en dos vías de ataque de peroxiácido : ya sea en el oxígeno o en el carbono del grupo carbonilo . [17] El ataque al oxígeno podría conducir a dos posibles intermediarios : Baeyer y Villiger sugirieron un intermediario dioxirano , mientras que Georg Wittig y Gustav Pieper sugirieron un peróxido sin formación de dioxirano. [17] El ataque con carbono fue sugerido por Rudolf Criegee . [17] En esta vía, el perácido ataca el carbono carbonilo, produciendo lo que ahora se conoce como el intermedio de Criegee . [17]
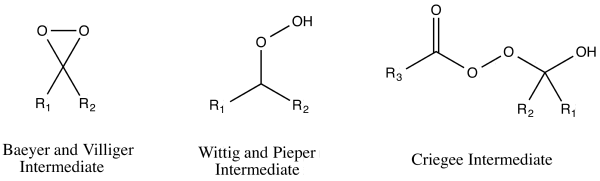
En 1953, William von Eggers Doering y Edwin Dorfman dilucidaron la vía correcta para el mecanismo de reacción de la oxidación de Baeyer-Villiger mediante el marcado con oxígeno-18 de benzofenona . [16] Los tres mecanismos diferentes conducirían cada uno a una distribución diferente de los productos etiquetados. El intermedio de Criegee conduciría a un producto únicamente etiquetado en el oxígeno del carbonilo. [16] El producto del intermedio de Wittig y Pieper solo está marcado en el grupo alcoxi del éster. [16] El intermedio de Baeyer y Villiger conduce a una distribución 1:1 de ambos productos anteriores. [16] El resultado del experimento de etiquetado apoyó el intermedio Criegee, [16] que ahora es la vía generalmente aceptada. [1]
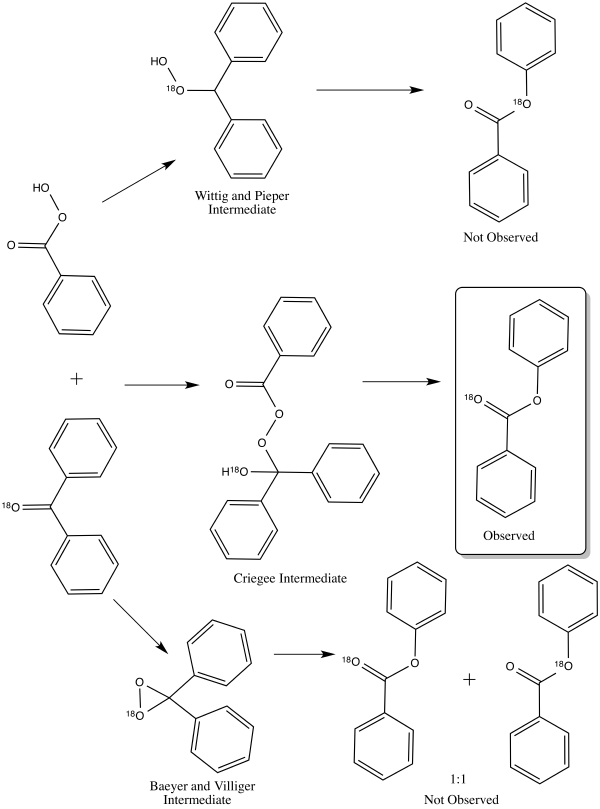
La migración no cambia la estereoquímica del grupo que se transfiere, es decir: es estereorretentiva . [18] [19]
Aunque se utilizan muchos peroxiácidos diferentes para la oxidación de Baeyer-Villiger, algunos de los oxidantes más comunes incluyen el ácido metacloroperbenzoico (mCPBA) y el ácido trifluoroperacético (TFPAA). [2] La tendencia general es que una mayor reactividad se correlaciona con un pK a más bajo (es decir, una acidez más fuerte) del ácido carboxílico correspondiente (o alcohol en el caso de los peróxidos). [5] Por lo tanto, la tendencia de reactividad muestra TFPAA > ácido 4-nitroperbenzoico > mCPBA y ácido perfórmico > ácido peracético > peróxido de hidrógeno > hidroperóxido de terc-butilo . [5] Los peróxidos son mucho menos reactivos que los peroxiácidos. [2] El uso de peróxido de hidrógeno requiere incluso un catalizador . [7] [20] Además, el uso de peróxidos orgánicos y peróxido de hidrógeno tiende a generar más reactividad secundaria debido a su promiscuidad. [21]
El uso de peroxiácidos y peróxidos al realizar la oxidación de Baeyer-Villiger puede provocar la oxidación indeseable de otros grupos funcionales . [22] Los alquenos y las aminas son algunos de los grupos que pueden oxidarse . [22] Por ejemplo, los alquenos en el sustrato, particularmente cuando son ricos en electrones, pueden oxidarse a epóxidos . [22] [23] Sin embargo, se han desarrollado métodos que permitirán la tolerancia de estos grupos funcionales. [22] En 1962, GB Payne informó que el uso de peróxido de hidrógeno en presencia de un catalizador de selenio produciría el epóxido a partir de alquenilcetonas, mientras que el uso de ácido peroxiacético formaría el éster. [24]

El uso de peróxido de hidrógeno como oxidante sería ventajoso, ya que haría la reacción más respetuosa con el medio ambiente, ya que el único subproducto es el agua. [7] Se ha informado que los derivados del ácido benceneselínico como catalizadores dan una alta selectividad con peróxido de hidrógeno como oxidante. [25] Otra clase de catalizadores que muestran alta selectividad con peróxido de hidrógeno como oxidante son los catalizadores sólidos de ácido de Lewis, como los estanosilicatos. [26] Entre los estanosilicatos, particularmente el zeotipo Sn-beta y el amorfo Sn-MCM-41 muestran una actividad prometedora y una selectividad cercana al total hacia el producto deseado. [27] [28]
Ha habido intentos de utilizar catalizadores organometálicos para realizar oxidaciones enantioselectivas de Baeyer-Villiger. [7] El primer caso reportado de una oxidación de una cetona proquiral utilizó dioxígeno como oxidante con un catalizador de cobre. [23] Siguieron otros catalizadores, incluidos compuestos de platino y aluminio . [23]
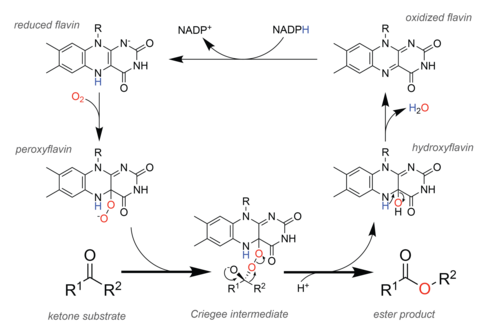
En la naturaleza, las enzimas llamadas monooxigenasas de Baeyer-Villiger (BVMO) realizan la oxidación de manera análoga a la reacción química. [29] Para facilitar esta química, los BVMO contienen un cofactor de flavina adenina dinucleótido (FAD) . [30] En el ciclo catalítico (ver figura a la derecha), el equivalente redox celular NADPH reduce primero el cofactor, lo que le permite reaccionar posteriormente con el oxígeno molecular . La peroxiflavina resultante es la entidad catalítica que oxigena el sustrato , y los estudios teóricos sugieren que la reacción se produce a través del mismo intermedio de Criegee que se observa en la reacción química. [31] Después del paso de reordenamiento que forma el producto éster , queda una hidroxiflavina, que elimina espontáneamente el agua para formar flavina oxidada, cerrando así el ciclo catalítico.
Los BVMO están estrechamente relacionados con las monooxigenasas que contienen flavina (FMO), [32] enzimas que también se encuentran en el cuerpo humano y funcionan dentro del sistema de desintoxicación metabólica de primera línea del hígado junto con las monooxigenasas del citocromo P450 . [33] De hecho, se demostró que el FMO5 humano es capaz de catalizar reacciones de Baeyer-Villiger, lo que indica que la reacción también puede ocurrir en el cuerpo humano. [34]
Los BVMO han sido ampliamente estudiados debido a su potencial como biocatalizadores , es decir, para una aplicación en síntesis orgánica. [35] Teniendo en cuenta las preocupaciones medioambientales de la mayoría de los catalizadores químicos, el uso de enzimas se considera una alternativa más ecológica. [29] Los BVMO en particular son interesantes para su aplicación porque cumplen una variedad de criterios típicamente buscados en biocatálisis: además de su capacidad para catalizar una reacción sintéticamente útil, se encontró que algunos homólogos naturales tenían un alcance de sustrato muy grande (es decir, su reactividad era no restringidos a un solo compuesto, como se supone a menudo en la catálisis enzimática), [36] pueden producirse fácilmente a gran escala y, debido a que se ha determinado la estructura tridimensional de muchos BVMO, la ingeniería enzimática podría aplicarse para producir variantes. con termoestabilidad y/o reactividad mejoradas . [37] [38] Otra ventaja del uso de enzimas para la reacción es su regio y enantioselectividad frecuentemente observada, debido al control estérico de la orientación del sustrato durante la catálisis dentro del sitio activo de la enzima . [29] [35]
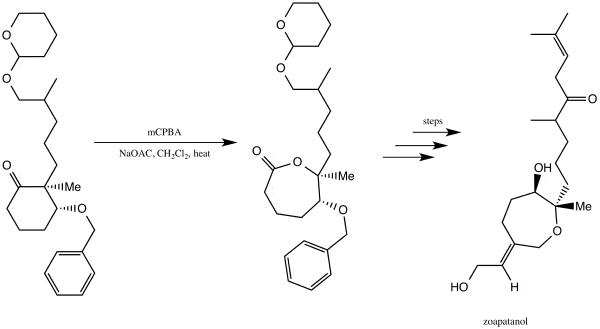
El zoapatanol es una molécula biológicamente activa que se encuentra naturalmente en la planta zeopatle, que se ha utilizado en México para preparar un té que puede inducir la menstruación y el parto. [39] En 1981, Vinayak Kane y Donald Doyle informaron sobre una síntesis de zoapatanol. [40] [41] Utilizaron la oxidación de Baeyer-Villiger para producir una lactona que sirvió como componente fundamental que finalmente condujo a la síntesis de zoapatanol. [40] [41]
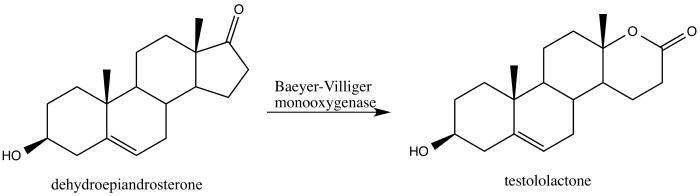
En 2013, Alina Świzdor informó sobre la transformación del esteroide dehidroepiandrosterona en un agente anticancerígeno testololactona mediante el uso de una oxidación de Baeyer-Villiger inducida por un hongo que produce monooxigenasas de Baeyer-Villiger. [42]