La olefinación de Julia ( también conocida como olefinación de Julia-Lythgoe ) es la reacción química utilizada en química orgánica de fenilsulfonas (1) con aldehídos (o cetonas ) para dar alquenos (olefinas) (3) después de la funcionalización del alcohol y la eliminación reductora utilizando amalgama de sodio [1] [2] o SmI 2 . [3] La reacción lleva el nombre del químico francés Marc Julia .
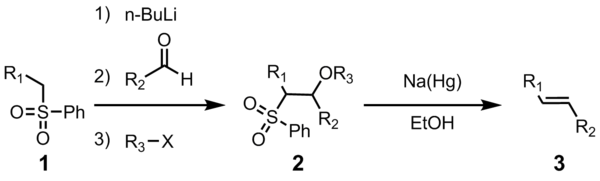
La utilidad de esta reacción de olefinación conectiva surge de su versatilidad, su amplia tolerancia al grupo funcional y las condiciones de reacción suaves en las que se desarrolla la reacción.
Los cuatro pasos se pueden llevar a cabo en un solo recipiente de reacción y el uso de R 3 X es opcional. Sin embargo, la purificación del intermediario de sulfona 2 conduce a un mayor rendimiento y pureza. La mayoría de las veces, R 3 es acetilo o benzoilo , y en la preparación de 2 se utiliza anhídrido acético o cloruro de benzoilo .
En 1973, Marc Julia y Jean-Marc Paris informaron sobre una nueva síntesis de olefinas en la que las β-aciloxisulfonas se eliminaban de forma reductiva para dar los correspondientes alquenos di-, tri- o tetrasustituidos. [4] Basil Lythgoe y Philip J. Kocienski exploraron el alcance y la limitación de la reacción, y hoy en día esta olefinación se conoce formalmente como olefinación de Julia-Lythgoe. [5] La reacción implica la adición de un carbanión estabilizado con sulfonilo a un compuesto carbonílico, seguida de la eliminación para formar un alqueno. En las versiones iniciales de las reacciones, la eliminación se realizaba en condiciones reductoras. Más recientemente, se desarrolló una versión modificada que evita este paso. La primera versión a veces se denomina olefinación de Julia-Lythgoe, mientras que la segunda se denomina olefinación de Julia-Kocienski. En la variante reductora, el aducto suele acilarse y luego tratarse con un agente reductor, como la amalgama de sodio [6] [7] o SmI 2 . [8] Se han publicado varias revisiones de estas reacciones. [9] [10]
Los pasos iniciales son sencillos. El anión fenilsulfona (2) reacciona con un aldehído para formar el alcóxido (3). El alcóxido se funcionaliza con R 3 -X para dar el intermedio estable (4). Se desconoce el mecanismo exacto de la reducción de la amalgama de sodio, pero se ha demostrado que se produce a través de una especie de radical vinílico (5) [11] . La protonación del radical vinílico da el producto deseado (6).

La estereoquímica del alqueno (6) es independiente de la estereoquímica del intermediario sulfona 4. Se cree que los intermediarios radicales pueden equilibrarse de modo que la trans-olefina, más estable termodinámicamente, se produce con mayor frecuencia. Esta transformación favorece en gran medida la formación del E -alqueno. [12]

La olefinación de Julia modificada, también conocida como olefinación de Julia en un solo recipiente, es una modificación de la olefinación de Julia clásica. La sustitución de las fenilsulfonas por heteroarilsulfonas altera en gran medida la vía de reacción. [13] El ejemplo más popular es la benzotiazolsulfona . [14] La reacción de la benzotiazolsulfona (1) con diisopropilamida de litio (LDA) da una benzotiazolilsulfona metalada, que reacciona rápidamente con aldehídos (o cetonas) para dar un intermedio de alcóxido (2). A diferencia de las fenilsulfonas, este intermedio de alcóxido (2) es más reactivo y sufrirá una transposición de Smiles [15] para dar la sal sulfinato (4). La sal sulfinato (4) eliminará espontáneamente el dióxido de azufre y la benzotiazolona de litio (5) produciendo el alqueno deseado (6).

Dado que la variante benzotiazol de la olefinación de Julia no implica el equilibrio de intermediarios, el resultado estereoquímico es resultado de la estereoquímica de la adición inicial de carbonilo. Como resultado, esta reacción a menudo genera una mezcla de estereoisómeros de alquenos.

La olefinación de Julia-Kocienski, un refinamiento adicional de la olefinación de Julia modificada, ofrece una muy buena selectividad E. En la olefinación de Julia-Kocienski [16] , el agente alquilante es un tetrazol . Procede con el mismo mecanismo que la sulfona de benzotiazol anterior. La alta selectividad E de la olefinación de Julia-Kocienski es el resultado de la adición diastereoselectiva controlada cinéticamente de 1-fenil-1H-tetrazol-5-il (PT) sulfonas metaladas a aldehídos no conjugados. Esto produce anti-β-alcoxisulfonas que se descomponen estereoespecíficamente en los E -alquenos. [17] En una adaptación, [18] con t-butiltetrazoilmetilsulfona, las condiciones de reacción son bis(trimetilsilil)amida de sodio a −70 °C en tetrahidrofurano o carbonato de cesio a +70 °C. Esta reacción recibe el nombre de Philip J. Kocienski por su modificación de la olefinación de Julia.

La reacción de olefinación de Julia o de Julia modificada es una transformación sintética potente y versátil, ampliamente utilizada en la construcción de productos naturales complejos con excelente control de la isomería geométrica.
El pterostilbeno es un estilbenoide químicamente relacionado con el resveratrol. Pertenece al grupo de las fitoalexinas, agentes producidos por las plantas para combatir infecciones. [19] El pterostilbeno es un análogo natural del resveratrol, el éter dimetílico. Se cree que el compuesto también tiene propiedades antidiabéticas , pero hasta ahora se ha estudiado muy poco sobre esta cuestión.
En comparación con las reacciones catalizadas por Wittig , Wittig-Horner, Perkin o metales de transición para sintetizar pterostilbeno, la olefinación de Julia ofrece un método alternativo simple y económico para la preparación de pterostilbeno. [20] [21]
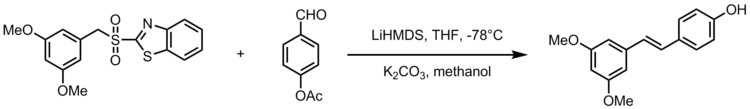
Una adaptación de la olefinación de Julia-Kocienski permite la síntesis del estilbenoide resveratrol , un compuesto natural que se encuentra en alimentos comunes como las uvas, los vinos y las nueces. El resveratrol es un estilbenoide biológicamente importante al que se le han sugerido muchos beneficios para la salud. La olefinación de Julia-Kocienski sirve como una reacción poderosa en la síntesis de análogos del resveratrol con 3,5-bis(trifluorometil)fenil sulfonas. El siguiente esquema muestra el esquema general para sintetizar análogos del resveratrol, donde R 2 es un grupo arilo. [22]

En la síntesis total asimétrica de (−)-calistatina A por Amos Smith , se utilizaron dos olefinaciones de Julia separadas para agregar dos fracciones de E -alqueno. [23] La (−)-calistatina A es un miembro de la familia de antibióticos de la leptomicina. El siguiente esquema muestra la olefinación de Julia-Kocienski utilizada para lograr el precursor del producto natural, como lo indica el uso de la PT-sulfona.
