Los complejos de clasificación endosómica necesarios para el transporte ( ESCRT ) están compuestos por complejos proteicos citosólicos , conocidos como ESCRT-0, ESCRT-I, ESCRT-II y ESCRT-III. Junto con una serie de proteínas accesorias, estos complejos ESCRT permiten un modo único de remodelación de membrana que da como resultado que las membranas se doblen o se alejen del citoplasma . [1] [2] Estos componentes ESCRT se han aislado y estudiado en varios organismos, incluidos la levadura y los humanos. [3] Esta maquinaria, una proteína característica de los eucariotas , se encuentra en todos los eucariotas y algunas arqueas . [4]
La maquinaria ESCRT desempeña un papel vital en una serie de procesos celulares, entre ellos la biogénesis de cuerpos multivesiculares (MVB), la abscisión celular y la gemación viral . La biogénesis de cuerpos multivesiculares (MVB) es un proceso en el que las proteínas marcadas con ubiquitina entran en orgánulos llamados endosomas a través de la formación de vesículas . Este proceso es esencial para que las células destruyan las proteínas mal plegadas y dañadas. [5] Sin la maquinaria ESCRT, estas proteínas pueden acumularse y provocar enfermedades neurodegenerativas . Por ejemplo, las anomalías en los componentes ESCRT-III pueden provocar trastornos neurológicos como la paraplejía espástica hereditaria (HSP). [6] La abscisión celular, el proceso por el que se escinde la membrana que conecta dos células hijas, también está mediada por la maquinaria ESCRT. Sin los complejos ESCRT, las células hijas no podrían separarse y se generarían células anormales que contuvieran el doble de cantidad de ADN . Estas células se destruirían inevitablemente a través de un proceso conocido como apoptosis . Por último, la gemación viral, o el proceso por el cual tipos específicos de virus salen de las células, puede no ocurrir en ausencia de la maquinaria ESCRT. Esto inevitablemente impediría que los virus se propagaran de una célula a otra.

Cada uno de los complejos ESCRT y las proteínas accesorias tienen estructuras únicas que permiten funciones bioquímicas distintas. Existen varios sinónimos para cada componente proteico de la maquinaria ESCRT, tanto para levaduras como para metazoos . A continuación se ofrece una tabla resumen de todas estas proteínas.
En la levadura existen los siguientes complejos/proteínas accesorias:
El complejo ESCRT-0 desempeña un papel vital en la generación de cuerpos multivesiculares mediante la unión y agrupamiento de proteínas ubiquitinadas y/o receptores en la superficie de una célula. El complejo es entonces responsable de la unión a un lípido en la membrana endosómica, que recluta estas proteínas marcadas al endosoma. [7] Una vez localizadas adecuadamente , estas proteínas son llevadas al endosoma a través de vesículas, formando cuerpos multivesiculares, y finalmente son entregadas al lisosoma donde son degradadas. Este proceso es esencial ya que es la vía principal para la degradación de proteínas dañadas que han pasado por el Golgi . [5] Los componentes del complejo ESCRT-0 existen de la siguiente manera:
El complejo es un heterodímero 1:1 de Vps27 ( proteína vacuolar de clasificación de proteínas 27) y Hse1 . [1] [6] Vps27 y Hse1 dimerizan a través de dominios GAT de bobina enrollada antiparalela (llamados así por las proteínas GGA y Tom1). [1] Tanto Vps27 como Hse1 contienen un dominio VHS amino-terminal (llamado así porque está contenido en las proteínas V ps27, H RS y S TAM). [8] Estos dominios VHS se unen a la ubiquitina en las proteínas que la célula pretende degradar. La ubiquitina también puede asociarse con motivos de interacción de ubiquitina como el de Hse1 o el dominio de doble cara que se encuentra en Vps27. Un dominio FYVE (llamado así por las cuatro proteínas en las que se identificó inicialmente: Fab1p, YOTB, Vac1 y EEA1) se encuentra intercalado entre los dominios de motivos de interacción de ubiquitina y VHS de Vps27. [6] [9] El fosfatidilinositol 3-fosfato , un lípido endosómico común, se une a este dominio FYVE, lo que da como resultado el reclutamiento de ESCRT-0 al endosoma. [6]
El papel del complejo ESCRT-I es ayudar en la generación de cuerpos multivesiculares mediante la agrupación de proteínas ubiquitinadas y actuando como un puente entre los complejos ESCRT-0 y ESCRT-II. [10] También desempeña un papel en el reconocimiento y remodelación de la membrana durante la abscisión de la membrana formando anillos a cada lado del cuerpo medio de las células en división. ESCRT-I también es responsable del reclutamiento de ESCRT-III, que forma la zona de constricción justo antes de que las células se separen. [11] Además, ESCRT-I desempeña un papel en la gemación viral al interactuar con proteínas virales específicas, lo que lleva al reclutamiento de maquinaria ESCRT adicional al sitio potencial de liberación viral. [12] Los detalles de la maquinaria ESCRT-I se describen a continuación.
El complejo ESCRT-I es un heterotetrámero (1:1:1:1) de Vps23, Vps28 , Vps37 y Mvb12. [3] El heterotetrámero ensamblado aparece como un tallo en forma de varilla compuesto de Vps23, Vps37 y Mvb12 con una tapa en abanico compuesta de hélices simples de Vps23, Vps28 y Vps37. [3] [6] Vps23 contiene un dominio variante de ubiquitina E2, que es responsable de la unión de la ubiquitina, el complejo ESCRT-0 y el motivo PTAP ( prolina , treonina , alanina , prolina ) de las proteínas Gag virales . [3] [6] Justo después de este dominio variante de ubiquitina E2, está presente un motivo rico en prolina (GPPX 3 Y ) que dirige a ESCRT - I al cuerpo medio durante la abscisión de la membrana. [6] Mvb12 también puede unirse a la ubiquitina a través de su extremo carboxiterminal . Vps28 es responsable de la interacción de ESCRT-I y ESCRT-II al asociarse con el dominio GLUE ( G RAM- Like U biquitin -binding in E AP45) de Vps36 a través de su dominio de haz de cuatro hélices carboxiterminal . [1]
El complejo ESCRT-II funciona principalmente durante la biogénesis de los cuerpos multivesiculares y la entrega de proteínas marcadas con ubiquitina al endosoma. Las proteínas marcadas con ubiquitina pasan de ESCRT-0 a ESCRT-I y luego a ESCRT-II. ESCRT-II se asocia con ESCRT-III, que cierra la vesícula que contiene la carga. [6] Los aspectos específicos de ESCRT-II son los siguientes:
ESCRT-II es un heterotetrámero (2:1:1) compuesto por dos subunidades Vps25 , una subunidad Vps22 y una subunidad Vps36 . [3] Las moléculas Vps25 contienen motivos PPXY, que se unen a los motivos de hélice alada (WH) de Vps22 y Vps36 creando un complejo en forma de Y con Vps22 y Vps36 como base y moléculas Vps25 como brazos. [3] [6] Las moléculas Vps25 también contienen motivos WH que son responsables de la interacción de ESCRT-II con ESCRT-III. Vps36 contiene un dominio GLUE que se une al fosfatidilinositol 3-fosfato y Vps28 de ESCRT-I. [3] [6] Dos dominios de dedos de zinc están enlazados en el dominio GLUE de Vps36 de levadura. Uno de estos dominios de dedos de zinc se une al dominio carboxiterminal de Vps28 y el otro se asocia con la ubiquitina. [6]
El complejo ESCRT-III es probablemente el más importante de toda la maquinaria ESCRT porque desempeña un papel en todos los procesos mediados por ESCRT. [13] Durante la abscisión de la membrana y la gemación viral, ESCRT-III forma filamentos largos que se enrollan alrededor del sitio de constricción de la membrana justo antes de la escisión de la membrana. [11] [14] Esta mediación de la abscisión ocurre a través de interacciones con el complejo centralspindlin . [15] Estas estructuras filamentosas también están presentes durante la formación del cuerpo multivesicular y funcionan como una cerca en forma de anillo que tapona la vesícula en gemación para evitar que las proteínas de carga escapen al citosol de la célula. [11] ESCRT-III existe y funciona de la siguiente manera:
El complejo ESCRT-III se diferencia de toda la demás maquinaria ESCRT en que existe solo transitoriamente y contiene componentes esenciales y no esenciales. [1] [11] Las subunidades esenciales deben ensamblarse en el orden adecuado (Vps20, Snf7, Vps24 y luego Vps2) para que la maquinaria funcione. [6] Las subunidades no esenciales incluyen Vps60, Did2 e Ist1. [11] Vps20 inicia el ensamblaje de ESCRT-III al actuar como un nucleador del ensamblaje del polímero Snf7. Luego, Vps24 se asocia con Snf7 para tapar el complejo y reclutar a Vps2. [1] [3] Luego, Vps2 lleva a Vps4 al complejo. [16] Todas las formas citosólicas "libres" de cada subunidad se consideran cerradas. Es decir, la porción carboxiterminal de cada subunidad se pliega sobre sí misma de manera autoinhibitoria, estabilizando las subunidades monoméricas . [1] [3] El extremo carboxiterminal de la mayoría de las subunidades ESCRT-III, tanto esenciales como no esenciales, contienen motivos MIM ( motivos que interactúan con el dominio de transporte e interacción de microtúbulos) . [ 17 ] Estos motivos son responsables de la unión de Vps4 y la espástina AAA-ATPasa . [3]
Las proteínas Vps4-Vta1 son necesarias para la eliminación de otros componentes de ESCRT (normalmente ESCRT-III) de las membranas una vez que se ha completado un proceso particular. Existe cierto debate sobre si Vps4 escinde el complejo ESCRT-III o remodela el complejo de modo que se elimine un componente en un momento determinado. [12] Se cree que Vta1 actúa como un activador de Vps4, ayudando a su ensamblaje y mejorando su actividad AAA-ATPasa. [13] [18] La forma en que funcionan estas proteínas es la siguiente:
Las subunidades de Vps4 tienen dos dominios funcionales, un dominio MIT amino-terminal y un dominio AAA-ATPasa central. [3] El dominio MIT es responsable de la interacción de Vps4 con el dominio MIM de Vps2. [1] El dominio AAA-ATPasa hidroliza ATP para impulsar el desmontaje del complejo ESCRT-III. [11] Esta “extracción” de ESCRT-III permite que todas las subunidades asociadas se reciclen para su uso posterior. [11] [12] Vta1 es una proteína dimérica que contiene un dominio VSL (llamado así porque se encuentra en las proteínas V ps4, S BP1 y L IP5), que permite la unión a Vps4, y un dominio MIT para asociarse con la subunidad Vps60 de ESCRT-III. Aunque no es esencial, se ha demostrado que Vta1 ayuda en el ensamblaje del anillo de Vps4, acelera la actividad ATPasa de Vsp4 y fomenta el desmontaje de ESCRT-III. [6]
La función principal de Bro1 es reclutar desubiquitinasas al complejo ESCRT-III. [19] Esto da como resultado la eliminación de las etiquetas de ubiquitina de las proteínas destinadas a la degradación en el lisosoma justo antes de la generación de cuerpos multivesiculares. También se ha especulado que Bro1 ayuda a estabilizar ESCRT-III mientras que las etiquetas de ubiquitina se escinden de las proteínas de carga. [19]
Bro1 contiene un dominio amino-terminal de Bro1 que se une a Snf7 de ESCRT-III. [20] Esta unión lleva a Bro1 al sitio de abscisión de la membrana. Bro1 también se une al dominio catalítico de Doa4, una ubiquitina hidrolasa (desubiquitinasa), llevándola al sitio de abscisión. Doa4 elimina la ubiquitina de las proteínas de carga que se dirigen al lisosoma. [20]
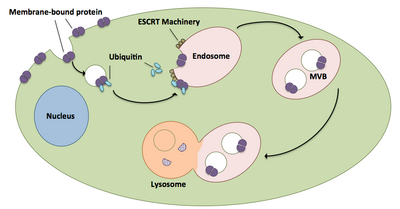
Los cuerpos multivesiculares desempeñan un papel importante en el transporte de proteínas y receptores ubiquitinados a un lisosoma. [21] Los complejos ESCRT transportan carga ubiquitinada a vesículas celulares que brotan directamente en el compartimento endosómico de la célula, formando cuerpos multivesiculares. [21] Estos cuerpos multivesiculares finalmente se fusionan con el lisosoma causando la degradación de la carga. [16] Existe una descripción más detallada del proceso, incluida la maquinaria asociada, a continuación:

La abscisión de la membrana durante la citocinesis es el proceso por el cual la membrana que conecta dos células hijas se escinde durante la división celular . Dado que se conserva en varias arqueas , se considera que la abscisión de la membrana es la función más temprana de la maquinaria ESCRT. [6] El proceso comienza cuando la proteína centrosomal Cep55 se recluta al cuerpo medio de las células en división en asociación con MKLP1, una proteína similar a la quinesina mitótica que se asocia con los microtúbulos. [6] [23] Luego, Cep55 recluta la subunidad Vps23 de ESCRT-I y la proteína accesoria ALIX, que forman anillos a cada lado del cuerpo medio. [6] [11] [12] ESCRT-I y ALIX reclutan a ESCRT-III a través de su subunidad Snf7. [6] Las subunidades ESCRT-III Vps20, Snf7, Vps24, Vps2 y Did2 forman una fibrilla en forma de espiral adyacente a los anillos formados por Vps23. [1] [12] [19] La formación de esta estructura en forma de espiral deforma la membrana y la espástina AAA-ATPasa es traída por Did2 e Ist1 para escindir los microtúbulos formados en el cuerpo medio. [12] [19] Luego, Vps4 cataliza el desmontaje del complejo ESCRT-III dando como resultado dos células hijas recién separadas. [19] El proceso de abscisión de la membrana se describió utilizando proteínas metazoarias, ya que el proceso se ha estudiado en mayor medida en metazoos.

La liberación de partículas virales, también conocida como gemación viral , es un proceso por el cual los viriones libres se liberan desde el interior de las células a través del secuestro de la maquinaria ESCRT de la célula huésped. [1] [14] Los retrovirus , como el VIH-1 y el virus linfotrópico T humano , así como varios virus con envoltura , incluido el virus del Ébola , requieren maquinaria ESCRT para salir de la célula huésped. [1] El proceso es iniciado por las proteínas Gag virales, las principales proteínas estructurales de las capas retrovirales, que interactúan con TSG101 del complejo ESCRT-I y la proteína accesoria ALIX. [12] [13] Las subunidades ESCRT-III (solo CHMP4 y CHMP2 son esenciales) [10] son reclutadas al sitio de gemación viral para contraer y cortar el cuello de la yema de una manera similar a la descrita para la abscisión de la membrana durante la citocinesis. [1] [6] [12] Luego, Vps4 recicla los componentes ESCRT-III al citosol y el virus se libera de la célula. [6] El mecanismo descrito aquí utiliza proteínas metazoarias, ya que la gemación viral se ha estudiado más ampliamente en los metazoos.