La microcistina-LR ( MC-LR ) es una toxina producida por las cianobacterias . Es la más tóxica de las microcistinas .
Las microcistinas son heptapéptidos cíclicos . Los siete aminoácidos que intervienen en la estructura de una microcistina incluyen los aminoácidos únicos ADDA y D -β-metil-isoaspartato ( D -β-Me-isoAsp). Además, las microcistinas contienen dos residuos variables, que hacen la diferenciación entre las variantes de microcistinas. Estas dos funcionalidades variables son siempre aminoácidos proteinogénicos estándar : en la microcistina-LR, estos son leucina y arginina .
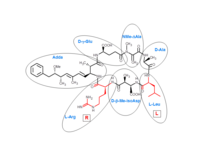
Hasta la fecha se han identificado más de 250 microcistinas [1], que representan diferencias en los dos residuos variables y algunas modificaciones en los otros aminoácidos. Estas modificaciones incluyen la desmetilación de Masp y Mdha y la metilesterificación de D -Glu. Las diferentes microcistinas tienen diferentes perfiles de toxicidad, siendo la microcistina-LR la más tóxica. [2] [3]
Las microcistinas son pequeños péptidos no ribosómicos . En Microcystis aeruginosa, la microcistina-LR es sintetizada por proteínas codificadas por un grupo de genes de microcistina de 55 kb ( mcy ) que contiene 6 genes grandes (más de 3 kb) que codifican proteínas con actividad de policétido sintasa , actividad de péptido sintasa no ribosómica ( mcyA-E y G ) y 4 genes más pequeños ( mcyF y HJ ). Estas proteínas grandes están formadas por diferentes dominios proteicos , denominados "módulos", que tienen cada uno su propia función enzimática específica. [4] Aunque los sistemas enzimáticos implicados en la biosíntesis de las microcistinas no son idénticos entre todas las cianobacterias, existen grandes similitudes y la mayoría de las enzimas esenciales se conservan. [4] [5]
La biosíntesis de la microcistina-LR en Microcystis aeruginosa comienza con el acoplamiento del fenilacetato a la enzima mcyG . En una serie de reacciones, catalizadas por diferentes módulos enzimáticos y enzimas, se forma la microcistina-LR. La ruta completa de biosíntesis de la microcistina-LR en Microcystis aeruginosa se ilustra en la figura.

Los primeros pasos de la síntesis implican la inserción de varios átomos de carbono y oxígeno entre el grupo acetilo y el grupo fenilo . Esta parte de la síntesis está catalizada por dominios enzimáticos que poseen actividad β-cetoacilsintasa, aciltransferasa, C-metiltransferasa y cetoacil reductasa. Al final de esta etapa, es decir, después de la primera condensación del glutamato, se forma el aminoácido Adda. [4] La segunda parte de la síntesis implica la condensación de los aminoácidos de los que se compone la microcistina. Así, en el caso de la microcistina-LR la condensación consecutiva de los aminoácidos ácido glutámico, metildeshidroalanina, alanina, leucina, ácido metilaspártico y arginina conduce al producto acoplado. Un ataque nucleofílico del nitrógeno en el residuo Adda da como resultado la liberación de la microcistina-LR cíclica. [4]
Las diferentes microcistinas son sintetizadas por las mismas enzimas [ aclaración necesaria ] que la microcistina-LR. [6]
La microcistina-LR inhibe las actividades de la proteína fosfatasa tipo 1 y tipo 2A ( PP1 y PP2A ) en el citoplasma de las células hepáticas. Esto conduce a un aumento en la fosforilación de proteínas en las células hepáticas. La interacción de la microcistina-LR con las fosfatasas incluye la formación de un enlace covalente entre un grupo metileno de la microcistina-LR y un residuo de cistina en la subunidad catalítica de la familia de las fosfatasas específicas de serina/treonina de la fosfoproteína fosfatasa (PPP), como la PP1 y la PP2A. Cuando la microcistina-LR se une directamente al centro catalítico de las enzimas PPP, bloquean por completo el acceso del sustrato al sitio activo y se produce la inhibición de la enzima. De esta manera, la proteína fosfatasa se inhibe y quedan más proteínas fosforiladas en las células hepáticas, lo que es responsable de la hepatotoxicidad de la microcistina-LR.
El sitio activo de las enzimas catalíticas PPP presenta tres surcos superficiales: el surco hidrofóbico, el surco ácido y el surco C-terminal, que tienen forma de Y con el sitio activo en el punto de bifurcación. La cadena lateral Adda de la microcistina-LR se acomoda al surco hidrofóbico, el sitio carboxílico D-Glu forma enlaces de hidrógeno con moléculas de agua unidas a metales y el grupo carboxilo del sitio Masp forma enlaces de hidrógeno con residuos conservados de arginina y tirosina en la enzima PPP. Finalmente, el grupo metileno en el sitio Mdha de la microcistina-LR se une covalentemente a un átomo de S de un residuo de cisteína, y el residuo de leucina se empaqueta estrechamente con otro residuo de tirosina conservado. [2]
La microcistina-LR es tóxica tanto para los humanos como para los animales. Existen resultados epidemiológicos de estudios que han demostrado síntomas de intoxicación atribuidos a la presencia de cianotoxinas en el agua potable. Los efectos se dividen en efectos a corto y largo plazo.
No existen informes verificables de muertes humanas conocidas que hayan sido causadas específicamente por la microcistina-LR, aunque hay informes de efectos sobre la salud después de la exposición y ha habido muertes atribuidas a las microcistinas en general. [7] Uno de los informes más destacados fue un brote en Caruaru , Brasil , en 1996. 116 pacientes experimentaron múltiples efectos: alteración visual, náuseas, vómitos y debilidad muscular. Cien desarrollaron insuficiencia hepática aguda y 52 sufrieron síntomas de lo que ahora se llama "Síndrome de Caruaru". [8] El síndrome fue causado por una terapia de diálisis con agua que no había sido tratada adecuadamente. [9]
La exposición a la microcistina-LR produce pocos efectos a corto plazo. Las microcistinas son compuestos principalmente hepatotóxicos , por lo que los efectos tóxicos perceptibles no son inmediatos. La mayoría de los estudios de toxicidad se han realizado con ratones que recibieron inyecciones intraperitoneales. El efecto más común es el daño hepático [10] . Dos de los síntomas más comunes son la gastroenteritis y la enfermedad hepática colestásica .
En un experimento con ratones, los animales murieron en pocas horas tras la inyección de una dosis letal de micocistina-LR. El daño hepático se hizo evidente en 20 minutos. En pocas horas, las células hepáticas murieron. [11]
La intoxicación aguda por microcistina-LR puede provocar lesiones a largo plazo, mientras que la exposición crónica a niveles bajos puede causar efectos adversos para la salud. Los estudios realizados en animales han demostrado que la exposición oral a la microcistina-LR puede provocar lesiones hepáticas crónicas. Incluso podría ser cancerígena . Se han detectado casos de cáncer durante estudios realizados en animales. La microcistina-LR en sí no causa cáncer, pero puede estimular el crecimiento de células cancerosas.
La microcistina-LR tuvo efectos en todos los animales, no sólo en los animales domésticos que nadaban en un río de agua potable con floraciones de cianobacterias. Los síntomas de intoxicación en animales domésticos incluyen diarrea, vómitos, debilidad y decúbito y son fatales en la mayoría de los casos [12] [13]
La microcistina-LR es tóxica para todos los animales, incluidos los animales consumidos por los seres humanos. Los peces y las aves también corren el riesgo de sufrir intoxicación por microcistina-LR.
Las cianobacterias prefieren vivir en cuerpos de agua como lagos, estanques, embalses y arroyos de movimiento lento. Cuando el agua está caliente hay suficientes nutrientes disponibles para que las bacterias sobrevivan. La mayoría de las cianobacterias producen toxinas, de las cuales la microcistina es solo un grupo. Cuando una cianobacteria muere, su pared celular se degrada mientras las toxinas se liberan en el agua. Las microcistinas son extremadamente estables en el agua y resisten la descomposición química como la hidrólisis o la oxidación. La vida media de esta toxina es de 3 semanas a pH 1 y 40 °C. Sin embargo, en condiciones típicas del medio ambiente, la vida media es de 10 semanas. [10] La contaminación del agua con microcistina-LR es resistente a los tratamientos de ebullición y microondas. [14]
Después de liberarse en el agua, las microcistinas son absorbidas activamente por los peces y las aves del agua intoxicada y, por lo tanto, ingresan a la cadena alimentaria . Los humanos también están expuestos a las microcistinas al realizar actividades en agua intoxicada. [15]
La microcistina-LR se excreta rápidamente del plasma sanguíneo. Las semividas plasmáticas para las etapas α y β, correspondientes a la distribución y eliminación, son respectivamente de 0,8 y 6,9 minutos. [16] [17] La depuración total del compuesto del plasma es de aproximadamente 0,9 ml/min. La excreción del compuesto se produce principalmente a través de las heces y la orina. Después de 6 días, aproximadamente el 24% de la ingesta se excreta del cuerpo, del cual aproximadamente el 9% se excreta a través de las heces y el 14,5% a través de la orina. [17]
La microcistina-LR se concentra principalmente en el hígado. Otros tejidos quedan expuestos a niveles mucho más bajos. [17]
Los datos sobre el metabolismo de la microcistina-LR en humanos son muy escasos. Los datos sobre el metabolismo y la disposición de la toxina en ratones y ratas están más ampliamente disponibles. En estos animales, la microcistina-LR se concentra rápidamente en el hígado. [18] La intoxicación de ratones con microcistina-LR condujo a una disminución en los niveles de citocromo P450 y citocromo b5 y un aumento del citocromo P420, en el que se convierte el CYP450. Junto con el hecho de que los ratones con una mayor concentración inducida de CYP450 se ven menos afectados por la toxina, esto sugiere que el CYP450 juega un papel importante en la desintoxicación del compuesto.
En la fase 2 de la biotransformación, el compuesto se conjuga con varias sustancias endógenas diferentes. Se sabe que la microcistina-LR se excreta como conjugado de glutatión, conjugado de cisteína y un conjugado dieno ADDA oxidado. El glutatión y la cisteína se conjugan con la fracción Mda. El ADDA oxidado se conjuga en el enlace conjugado . [19]
Los efectos tóxicos de las cianotoxinas son muy diversos e incluyen neurotoxicidad , hepatotoxicidad y citotoxicidad con quemaduras químicas . Las microcistinas se asocian generalmente con hepatotoxicidad. El efecto tóxico de las microcistinas se debe a su inhibición de las fosfatasas proteicas. [20]
Se han realizado muchos estudios con administración intraperitoneal . Debido a las diferencias en lipofilicidad y polaridad entre las diferentes microcistinas, no se puede suponer que la DL50 intraperitoneal predecirá la toxicidad después de la administración oral. [10]
Las microcistinas son hepatotoxinas. Tras una exposición aguda, se observan daños hepáticos graves por la alteración de la estructura de las células hepáticas. El peso del hígado aumenta debido a hemorragia intrahepática , shock hemodinámico, insuficiencia cardíaca y muerte. [10]
Tras la administración nasal de microcistina-LR, el epitelio de la mucosa nasal de las zonas olfativa y respiratoria sufrió necrosis. Incluso se observaron lesiones hepáticas tras la administración oral. La DL50 para la administración nasal es igual a la de la administración intraperitoneal.
Para evaluar los posibles efectos crónicos sobre la salud humana, lo más recomendable es realizar estudios que incluyan la administración oral repetida de microcistinas puras en distintos niveles de dosis. En un estudio con ratones, se administró mirocistina-LR pura por vía oral en dosis de 0, 40, 200 o 1000 μg/kg de peso corporal. Con la dosis más alta, casi todos los ratones mostraron cambios hepáticos e inflamación crónica y algunos otros síntomas. En los ratones hembra, solo se observaron cambios en las transaminasas con la dosis más alta. [10]
Los ratones mostraron nódulos hepáticos neoplásicos después de 100 administraciones orales de 20 μg/kg de peso corporal. Los nódulos observados tenían un diámetro de hasta 5 mm. Sin embargo, ningún ratón mostró nódulos hepáticos después de 100 administraciones de 80 μg/kg.
El comité del IARC concluyó que la microcistina-LR es posiblemente cancerígena para los seres humanos. Por lo tanto, la microcistina-LR en sí no es un carcinógeno, pero estimula el crecimiento de tumores. Los ratones tratados con el compuesto cancerígeno dimetilbenzatraceno mostraron un aumento en la cantidad y el peso de los tumores de la piel. [7]
Se sabe muy poco sobre la toxicidad aguda para los humanos, pero se han realizado estudios en animales que muestran los siguientes resultados.
Cuando las microcistinas se inyectan por vía intravenosa o intraperitoneal , se localizan en el hígado. Esto parece ser el resultado de la absorción por los hepatocitos . El informe de la OMS afirma que las microcistinas son letales para los ratones cuando se exponen intraperitonealmente a 25 a 150 μg/kg de peso corporal. [10] Quizás debido a la mala absorción después de la exposición, las microcistinas administradas por vía oral son menos tóxicas, ya que una dosis letal en ratones es de aproximadamente 5 a 10 μg/kg de peso corporal. La hepatotoxicidad en forma de necrosis hepática ocurre dentro de los 60 minutos posteriores a una dosis intravenosa. [20] Las floraciones de Microcystis aeruginosa no causaron un aumento en las tasas de tumores en grupos de ratones tratados durante hasta un año. Se muestra que los ratones que recibieron 20 μg/kg de peso corporal 4 veces por semana durante un período de 28 semanas desarrollaron neoplasias del hígado. [20] Sin embargo, los resultados son ambiguos. Por vía oral, la microcistina-LR presenta una toxicidad aguda en roedores. Es evidente que una cantidad significativa de la dosis oral atraviesa la barrera intestinal.
Las microcistinas no parecen mostrar toxicidad en el desarrollo.
La OMS afirma que la microcistina-LR no tiene efectos mutagénicos. Sin embargo, se ha observado la inducción de roturas de cadenas de ADN en linfocitos en ratones después de una administración oral única. El efecto depende del tiempo y de la dosis. No hay cambios en la expresión de genes seleccionados involucrados en la respuesta celular al daño del ADN después de una exposición de 4 horas. Después de 24 horas, los genes que responden al daño del ADN estaban regulados positivamente, lo que indica que la microcistina-LR es un agente genotóxico indirecto. [22] En China, la mayor incidencia de cáncer de hígado ocurre en áreas con abundantes cianobacterias en las aguas superficiales. El desarrollo de tumores está asociado con la exposición a bajas concentraciones durante un largo período de tiempo. [20]
Los estudios in vitro demostraron que la microcistina-LR es un potente inhibidor de la proteína fosfatasa 1 (PP-1) y PP2A , pero no tiene efecto sobre la proteína quinasa C o la quinasa dependiente de AMP cíclico . No parece producirse mutagenicidad en el caso de las toxinas purificadas derivadas de Microcystis , aunque las toxinas fueron clastogénicas para los linfocitos humanos. [20]
Una enzima metaloproteasa aislada de bacterias en el lago Rotorua , entre otros lugares, se llama microcistinasa . Esta enzima en particular convierte las microcistinas en productos con una toxicidad 160 veces menor. [23]
El general chino Zhu-Ge Liang fue el primero en observar el envenenamiento por cianobacterias hace unos 1000 años. Informó de la muerte de tropas que bebieron agua de color verde de un río en el sur de China. [ cita requerida ] El primer informe publicado de un incidente de envenenamiento por cianobacterias data del envenenamiento de un lago australiano en 1878. [24] También, en China y Brasil, la gente murió después de beber agua de un lago. Todos estos incidentes se han atribuido a las cianobacterias y al compuesto tóxico microcistina-LR. Esa es la razón por la que la Organización Mundial de la Salud (OMS) emitió una guía para microcistinas en agua potable. La guía de la OMS para microcistinas en agua potable, basada en microcistina-LR, es de 1 μg/L. [16] Con los altos niveles de eutrofización en Sudáfrica, las exposiciones típicas pueden ser tan altas como 10 μg/L. [25] [26] [27] [28]