Torovirus es un género de virus ARN envuelto de cadena positiva del orden Nidovirales y la familia Tobaniviridae . [1] Infectan principalmentea vertebrados , especialmente ganado, cerdos y caballos. [2] Las enfermedades asociadas con este género incluyen gastroenteritis , [2] que se presenta comúnmente en mamíferos. [3] Torovirus es el único género de lasubfamilia monotípica Torovirinae . [4] Torovirus también es un taxón monotípico, que contiene solo un subgénero, Renitovirus . [4]
El descubrimiento del primer torovirus se remonta a la década de 1970. El torovirus equino (EToV) se encontró accidentalmente en la muestra rectal de un caballo que sufría una diarrea grave . El torovirus bovino "Breda" se encontró más tarde en 1979 durante una investigación en una granja lechera de Breda. Habían tenido varios terneros que sufrieron diarrea grave durante meses. En 1984, se detectaron partículas similares al torovirus con la técnica del microscopio electrónico (EM) en pacientes humanos con gastroenteritis. [5]

Los torovirus (ToV) son virus de ARN monocatenario que tienen una envoltura con peplómero que a menudo se correlaciona con las infecciones entéricas en el ganado y posiblemente en los humanos. Estos virus parecen estar presentes en todo el mundo; se ha informado de la aparición de ToV en países de varios continentes como Europa, América, Nueva Zelanda y Sudáfrica. [6] Las partículas de torovirus suelen poseer una nucleocápside helicoidal y simétrica que se enrolla en una forma cilíndrica hueca. El diámetro es de aproximadamente 23 nm con una longitud media de 104 nm, donde cada ciclo de giro tiene intervalos de 4,5 nm. [5] Los ToV son pleomórficos, con un tamaño que varía de 100 nm a 150 nm con excrecencias en forma de maza que se extienden desde la cápside. [7] [8] También se ha descubierto una nucleocápside con forma de rosquilla con simetría helicoidal en los torovirus . [2] [9] Entre las diversas especies de Torovirus , solo el torovirus equino (EToV) puede cultivarse en el medio de cultivo celular, por lo que los EToV han sido estudiados más extensamente. La información de los estudios de inmunofluorescencia y la morfología de las células intestinales de los Torovirus bovinos (BToV) ha demostrado similitudes entre los EToV y los BToV. [6] Los Torovirus comparten algunas características comunes con los miembros de la familia relacionada Coronaviridae, ya que son virus redondos, pleomórficos y con envoltura de aproximadamente 120 a 140 nm de diámetro. [9] [10]
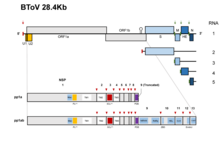
Los torovirus tienen una sola pieza de ARN monocatenario de sentido positivo . La longitud total es de aproximadamente 25-30 kb y poseen un mecanismo de replicación complejo que incluye el uso de ARNm subgenómico , cambio de marco ribosómico y tartamudeo de la polimerasa . [11] La longitud genómica del torovirus bovino es de aproximadamente 28,5 kb que se compone principalmente de un gen, el gen de la replicasa (20,2 kb). Este gen contiene dos marcos de lectura abiertos , ORF1a y ORF1b que codifican las proteínas pp1a y pp1b. [12] La primera secuencia genómica del PToV (torovirus porcino) se realizó en Shanghái, China en 2014. Se encontró que la longitud del genoma del torovirus porcino era de 28301 pb y posee un 79% de identidad de secuencia con el genoma del torovirus bovino. [13]

El ganado, los cerdos y los caballos son los huéspedes naturales de los torovirus y se cree que la infección se produce por vía fecal-oral . [2]
El genoma del Torovirus codifica varias proteínas estructurales como las proteínas de espiga (S), las proteínas de membrana (M), la hemaglutinina-esterasa (HE) y la nucleocápside (N) que les proporciona la caracterización estructural necesaria para la infección y para completar su ciclo de vida. [11] Las primeras tres regiones codificantes de proteínas se eliminan en las especies de BEV, lo que les permite crecer en el cultivo celular, mientras que otras especies no pueden crecer en el cultivo celular. [14] Los dos tercios iniciales del genoma del torovirus tienen dos marcos de lectura abiertos , ORF1a y ORF1b. ORFb1 encierra un dominio que codifica las enzimas como la ARN polimerasa dependiente de ARN (RdRp) y la helicasa (Hel) que son necesarias para la transcripción y traducción del virus. [15]
El ciclo de vida de los torovirus implica la replicación dentro de la célula huésped infectada. Estos virus se desarrollan predominantemente en el lumen de las cisternas de Golgi en el citoplasma . El EToV se puede observar en varias partes del aparato de Golgi y también en las regiones extracelulares. [16] Las nucleocápsides de estos virus en la región extracelular tienen una forma característica de toro, mientras que estas nucleocápsides tienen forma de bastón antes de la brotación en la célula huésped, lo que indica que se produce algún cambio morfológico en la etapa de maduración del virus. Además, las nucleocápsides del BToV y del EToV también se acumulan en el núcleo de la célula infectada. [11]
En el ganado, la enfermedad causa diarrea y signos sistémicos como pirexia , letargo y anorexia. En los terneros, puede causar signos neurológicos y conducir a la muerte en algunos casos. Actualmente se encuentran disponibles muchas técnicas de diagnóstico para la infección por torovirus en muestras clínicas, como la hemaglutinación (HA), el ensayo inmunoabsorbente ligado a enzimas ( ELISA ), la microscopía electrónica inmunitaria, las pruebas de inhibición de la hemaglutinación (HA/HI) y la hibridación de ácidos nucleicos. [17] La mayoría de los torovirus que infectan a los humanos probablemente estén estrechamente relacionados con BRV o BEV y se relacionen con cualquier historial previo de alguna enfermedad o infección entérica . También es la razón por la que las técnicas moleculares se consideran más prometedoras que los ensayos serológicos. Los cerdos pueden infectarse sin mostrar signos ni síntomas que sean físicamente visibles. [ cita requerida ]
El diagnóstico de la infección viral implica microscopía electrónica , ELISA o inhibición de la hemaglutinación . [ cita requerida ]
Se puede administrar un tratamiento de apoyo para prevenir la deshidratación y las infecciones secundarias. El control se basa en buenas medidas de bioseguridad , incluido el aislamiento y la desinfección rápidos de las instalaciones. Como las infecciones por torovirus generalmente se relacionan con diarrea grave, a menudo conducen a deshidratación. El tratamiento más común incluye administrar terapias líquidas a los pacientes más jóvenes, ya que la infección es más común en la población humana más joven, así como en el ganado. No existen medidas preventivas específicas para el control de la infección por torovirus. Las buenas prácticas de higiene y bioseguridad son efectivas en la prevención de la infección por torovirus. Además, se puede administrar calostro que contenga anticuerpos a los pacientes con una dosis estimada de 500 ml / día. [18] El curso natural de la infección más investigado se realiza en el ganado, ya que el origen del virus está relacionado con la enfermedad entérica en el ganado. En un experimento asociado con la infección del ganado, se obtuvieron los resultados de que el virus comúnmente se transmite en condiciones convencionales. Los síntomas iniciales en los terneros mostraron el desarrollo de diarrea en los primeros 2 a 3 días de la infección. La mayoría de los terneros tenían una deshidratación leve y algunos desarrollaron fiebre leve. Sin embargo, ninguno de los casos requirió intervención terapéutica y fueron tratados generalmente con cambios en la dieta de los terneros infectados. [19] Una investigación de (Vanopdenbosch et al., 1992a) publicó un estudio que indicaba que las infecciones respiratorias por torovirus surgen principalmente en el primer mes de vida y de los 4 a 6 meses de edad en el pico de la temporada de otoño. En todas esas infecciones, alrededor del 25% de las infecciones conducen a muerte súbita. Además de otras causas como diarrea, neumonía y problemas respiratorios, también se han reportado síntomas relacionados con el sistema nervioso central en algunos casos incidentales. [20] Los estudios también revelan que los terneros jóvenes infectados con el torovirus necesitan recibir terapias de fluidos ya que su cuerpo puede enfrentar una deshidratación severa durante la infección. Sin embargo, los adultos se recuperan por su respuesta inmune sin ningún tratamiento externo si no hay infecciones adicionales presentes. Muchos investigadores también sugieren que la desinfección y la esterilización por calor podrían destruir fácilmente el virus, pero hasta ahora no hay datos científicos ni informes de tales resultados. [ cita requerida ]
En 1984, se observaron partículas similares a torovirus en pacientes humanos con gastroenteritis o diarrea severa. [21] [22] Luego comenzaron a surgir varios estudios de casos en varias partes del mundo. Las partículas similares a torovirus (ToVL) se informaron en estudios científicos de EE. UU., Francia, Países Bajos, Canadá, Gran Bretaña, India y Brasil. [23] La presencia de ToVL se informó principalmente en niños y adultos con diarrea severa. El término torovirus humano (HuTV) se usa a menudo para describir las partículas ToVL. [ cita requerida ]
Debido a que existe una gran similitud entre el virus HuTV y el virus BoTV, se siguen ciertos criterios para detectar y diferenciar ambas cepas. En el pasado se han realizado numerosos estudios para relacionar los torovirus y su patogenicidad. Se han encontrado torovirus en diversas enfermedades intestinales tanto en niños como en adultos. Un estudio de la excreción fecal de torovirus concluyó que de 206 casos examinados, en alrededor de 72 (35%) casos se encontró torovirus. En comparación con las infecciones por rotavirus o torovirus, los torovirus se encontraron con mayor frecuencia en las personas inmunodeprimidas. Las infecciones por torovirus se caracterizaron por una reducción de los vómitos y un aumento de la diarrea sanguinolenta. La respuesta de anticuerpos del sistema inmunológico se desarrolló principalmente en los niños adultos que no estaban inmunodeprimidos. [24]
Además de la gastroenteritis, también se han encontrado torovirus en los bebés con enterocolitis necrotizante . Sin embargo, en el mismo estudio, la gravedad de la enfermedad y la mortalidad no se vieron muy afectadas en los pacientes con torovirus en comparación con los pacientes que dieron negativo en la prueba del torovirus. [25]
Se ha propuesto que los torovirus bovinos tienen principalmente dos serotipos diferentes: el serotipo 1 del torovirus bovino (BoTV-1) y el serotipo 2 del torovirus bovino (BoTV-2). [26] Ambos serotipos de BoTV poseen una hemaglutinina que reacciona con los eritrocitos de ratones y ratas, pero no con los eritrocitos humanos . El BoTV no se eluye de los eritrocitos de rata después de 90 minutos a 36 °C. Ambos serotipos del torovirus bovino poseen una hemaglutinina que reacciona con los glóbulos rojos en los roedores por lo general. [27] Hasta el momento, no hay evidencia que sugiera esa reacción con los eritrocitos humanos. Sin embargo, muchos estudios recientes revelaron la presencia del torovirus en humanos asociada con muchas otras infecciones entéricas, diarrea y afecciones como la gastroenteritis. [ cita requerida ]
El mecanismo exacto por el cual el virus induce diarrea es actualmente desconocido, pero los estudios revelan que podría deberse a la infección y muerte de células en el intestino delgado y criptas de vellosidades así como los enterocitos de criptas superficiales en el intestino grueso. También se dice que la diarrea acuosa podría deberse a lesiones en el colon que conducen a la reducción de la absorción de agua por las células en el intestino grueso. La patogenicidad de la presencia del torovirus ha sido ampliamente estudiada y explorada en la especie bovina, especialmente en terneros en la etapa inicial de vida alrededor de los 4 a 6 meses de edad. [27] Una vez que el BoTV ha sido inoculado por un animal por vía oral o nasal, infecta las células epiteliales de las vellosidades y luego se extiende a los componentes del sistema digestivo como el intestino grueso en las criptas del yeyuno , íleon y colon. En última instancia, resulta en diarrea dentro de las 24 a 72 horas de la infección. [28] [29] Los antígenos de BToV también se han reportado en las células epiteliales de la cúpula y las células microplegadas , presentes en el tejido linfoide asociado al intestino de la placa de Peyer en el intestino delgado. [28] Algunos investigadores sugieren que el BToV solo infecta a los enterocitos absortivos. Sin embargo, hay investigadores que también sugieren que la replicación viral podría comenzar en las células epiteliales inmaduras de las criptas y puede extenderse aún más a las vellosidades. [30]
El descubrimiento del primer torovirus se remonta a la década de 1970. El torovirus equino (EToV) se encontró accidentalmente en la muestra rectal de un caballo que tenía diarrea severa . El torovirus bovino 'Breda' se encontró más tarde en 1979 durante una investigación en una granja lechera en Breda. Tenían varios terneros que habían tenido diarrea severa durante meses. En 1984, se detectaron partículas similares al torovirus con la técnica de microscopio electrónico (EM) en los pacientes humanos con gastroenteritis. [5] En 1972, se aisló un virus de un caballo en Berna, Suiza. El virus no reaccionó con antisueros contra virus equinos conocidos y se demostró que tenía una morfología y subestructura únicas. [31] En 1982, se aisló un virus similar, no clasificado, de terneros en Breda, Iowa. [27] En 1984, se descubrieron partículas parecidas a estos virus en las heces de humanos. [21] En el 6º Congreso Internacional sobre Taxonomía de Virus celebrado en 1984 en Sendai (Japón), se propuso una nueva familia de virus, Toroviridae. [32] Sin embargo, actualmente la familia está asignada como familia Tobaniviridae, con la subfamilia Torovirinae , orden Nidovirales. [33]
Hasta hace poco, los torovirus no tenían asignada ninguna familia. El reciente análisis molecular del virus reveló sus similitudes con Arterivirus y coronavirus, lo que llevó a la inclusión del Torovirus junto con el Arterivirus en el anteriormente monogenérico Coronaviridae. [34] En la actualidad, los torovirus están incluidos en el orden Nidovirales subfamilia Torovirinae , familia Tobaniviridae . Los investigadores observan semejanzas, similitudes moleculares y genéticas, dimensiones del virión , vínculos de comportamiento y otras similitudes y diferencias características para la clasificación taxonómica del virus. En los torovirus, el virus de Berna ha sido ampliamente estudiado a nivel molecular en comparación con sus otros miembros. En 1992, el Comité Internacional de Taxonomía de Virus ICTV obtuvo suficientes datos para considerar al torovirus en la familia de los coronavirus debido a las similitudes en la estructura, el comportamiento de replicación y la secuenciación genética. [ cita requerida ]
Los torovirus, coronavirus y arterivirus pertenecen al orden Nidovirales , un grupo de virus animales monocatenarios de sentido positivo y no segmentados. [35] A pesar de las diferencias en el tamaño de su genoma, la variedad de hospedadores y sus estrategias de replicación, las similitudes en las identidades de secuencia de las proteínas replicasas entre diferentes especies del orden Nidovirales aseguran su ascendencia común. [36] El análisis de secuencia y la comparación de los dominios de polimerasa y helicasa de coronavirus y torovirus revelaron un 40-45% de aminoácidos idénticos en ambas familias, lo que proporciona evidencias de una gran distancia evolutiva entre las dos familias. [11]
{{cite journal}}: CS1 maint: publicación periódica sin título ( enlace )