Los inhibidores de la renina son fármacos que inhiben la actividad de la renina que se encarga de hidrolizar el angiotensinógeno a angiotensina I , [2] [3] [4] que a su vez reduce la formación de angiotensina II que facilita la presión arterial . [5] [6]
El inhibidor de la renina suele ir precedido de un inhibidor directo de la renina , llamado inhibidor directo de la renina para distinguir su mecanismo de otros fármacos que interfieren con el sistema renina-angiotensina-aldosterona , como los inhibidores de la enzima convertidora de angiotensina (IECA), los bloqueadores de los receptores de angiotensina (BRA) y los antagonistas de los receptores de aldosterona . [6]
Estos fármacos inhiben el primer paso y limitante de la velocidad del sistema renina-angiotensina-aldosterona (SRAA), es decir, la conversión de angiotensinógeno en angiotensina I. Esto conduce a una ausencia total de angiotensina II basándose en el razonamiento de que la renina solo actúa para inhibir este paso, a diferencia de la enzima convertidora de angiotensina, que también participa en otras reacciones bioquímicas. Desde la década de 1970, los científicos han intentado desarrollar inhibidores potentes con una biodisponibilidad oral aceptable . [7] [8] El proceso fue difícil y tomó alrededor de tres décadas. La primera y segunda generación enfrentaron problemas como una escasa biodisponibilidad y falta de potencia. Finalmente, se descubrió la tercera generación. Estos compuestos eran inhibidores de renina no peptídicos , tenían una biodisponibilidad oral aceptable y eran lo suficientemente potentes para uso clínico. El primer fármaco de esta clase fue el aliskiren , que recibió aprobación de comercialización en 2007. [7] En junio de 2020 [actualizar], es el único inhibidor de la renina en el mercado.
En 1896, el fisiólogo finlandés Robert Tigerstedt y el médico sueco Per Bergman realizaron un experimento sobre los riñones y el sistema circulatorio de conejos. Observaron que la presión arterial aumentaba en los conejos cuando se inyectaban extractos de riñones en sus venas yugulares . [9] [10] También descubrieron que esta sustancia responsable de la presión arterial más alta se producía en la corteza renal y la llamaron renina . [10] Aunque este experimento sentó las bases para futuras investigaciones sobre la vía RAAS, tuvo poco impacto en la comunidad científica en ese momento. [9] [11] En 1934, cuando Goldblatt publicó su trabajo sobre la isquemia renal , la renina volvió a ser objeto de atención. Sin embargo, la importancia de la renina en la patogénesis de las enfermedades cardiovasculares no se entendió completamente hasta la década de 1970, y 20 años más tarde los primeros inhibidores de la renina pasaron a ensayos clínicos . [7]
La pepstatina , que se describió en 1972, fue el primer inhibidor sintético de la renina, pero sus malas propiedades farmacocinéticas le impidieron entrar en investigaciones in vivo . [8] [12] La primera generación de inhibidores de la renina, como el H-142, eran análogos peptídicos del angiotensinógeno . [13] Sin embargo, estos inhibidores también tenían propiedades limitadas similares a las de los fármacos. [7] [12] Las esperanzas de un gran avance aparecieron en 1982, cuando comenzó el desarrollo de los inhibidores de la renina de segunda generación. [7] Esta generación estaba formada por compuestos similares a péptidos, como remikiren , enalkiren y zanikiren. [11] Tenían propiedades más parecidas a las de un fármaco que a las de un sustrato, y en 1990 fueron a ensayos clínicos. La segunda generación tuvo sus limitaciones y nunca completó los ensayos clínicos. [7]
Aliskiren, el único inhibidor de la renina que ha entrado en ensayos clínicos de fase III, no está relacionado estructuralmente con los péptidos, lo que lo convierte en un inhibidor de la renina de tercera generación. [7] [14] El primer ensayo clínico se realizó en el año 2000 en voluntarios sanos. [15] En 2007, el aliskiren fue aprobado por la Administración de Medicamentos y Alimentos de EE. UU. y la Agencia Europea de Medicamentos como tratamiento para la hipertensión . [7] Una revisión sistemática realizada por el grupo Cochrane de Hipertensión encontró que la dosis máxima recomendada de aliskiren produjo una disminución apreciable de la presión arterial en comparación con el placebo. [dieciséis]


El sistema renina-angiotensina-aldosterona (SRAA) desempeña un papel clave en la patología de las enfermedades cardiovasculares , la hipertensión , la enfermedad renal diabética y la insuficiencia cardíaca . [17] En condiciones normales, la estimulación del SRAA se produce en respuesta a amenazas que comprometen la estabilidad de la presión arterial , como hipotensión , pérdida de sangre y pérdida excesiva de sodio y agua. La presión arterial depende de la resistencia periférica total y del gasto cardíaco .
La proteasa aspártica renina, altamente selectiva, se secreta a partir del aparato yuxtaglomerular , que es la única fuente de renina activa, [18] aunque su precursora, la prorenina , puede ser secretada por otros tejidos , como las glándulas salivales, el cerebro, el corazón y los vasos sanguíneos. . [18] [19] [20] La renina es una enzima circulante que actúa sobre un péptido circulante , el angiotensinógeno. [21] La renina escinde el péptido en el enlace Leu10-Val11, y esta reacción es el paso determinante de la velocidad del RAAS. [22] Esto conduce al producto angiotensina I (Ang I), que es un decapéptido . La enzima convertidora de angiotensina (ECA) descompone la Ang I en el octapéptido activo angiotensina II (Ang II), que es el principal efector del SRAA. [21] Ang II estimula la retención renal de sodio; promueve la secreción de aldosterona ; Provoca vasoconstricción y aumenta la actividad del sistema nervioso simpático . [20] [23] Ang II también proporciona una retroalimentación negativa al sistema al inhibir la liberación de renina por el aparato yuxtaglomerular. [23] Ang II interactúa con al menos dos clases de receptores de Ang II , AT1 y AT2 . [20] Este mecanismo, que va desde la renina a través de Ang II y hasta la aldosterona, así como la retroalimentación negativa que Ang II tiene sobre la secreción de renina, se conoce como SRAA. [23] El efecto neto es aumentar la presión arterial, lo que en fisiología normal es necesario para mantener la homeostasis .
Se sospecha que la hipertensión esencial, un trastorno heterogéneo cuyos efectos a largo plazo pueden ser daños en los órganos terminales , puede implicar, al menos en algunos casos, una hiperactividad de este sistema, que varios tipos de medicamentos intentan contrarrestar. [21] La concentración de renina en el plasma sanguíneo tiende a ser mayor en personas más jóvenes con hipertensión cuando la vasoconstricción puede ser la razón principal de la presión arterial alta. Por el contrario, la renina es más baja en las personas mayores o en las personas de etnia afroamericana o caribeña africana, cuando la retención de sal puede contribuir más a la presión arterial elevada. [21] Sin embargo, el papel de los niveles de renina plasmática en la etiología y el tratamiento de la hipertensión es controvertido. [24]
Los inhibidores de la renina se unen al sitio activo de la renina e inhiben la unión de la renina al angiotensinógeno, que es el paso determinante de la velocidad de la cascada del SRAA. [21] En consecuencia, los inhibidores de la renina previenen la formación de Ang I y Ang II. Los inhibidores de la renina también pueden prevenir la formación de Ang-(1-7), Ang-(1-9) y Ang-(1-5), [25] aunque no se sabe si esto es clínicamente importante. La renina es altamente selectiva por su único sustrato natural, que es el angiotensinógeno, y la incidencia de efectos secundarios no deseados con un inhibidor de renina es poco frecuente. [26] y similar a los antagonistas del receptor de angiotensina II . [27] Ang II también funciona dentro del RAAS como una retroalimentación negativa para suprimir una mayor liberación de renina. Una reducción de los niveles de Ang II o el bloqueo de los receptores de angiotensina suprimirá el circuito de retroalimentación y provocará un aumento de las concentraciones de renina plasmática (PRC) y de la actividad de renina plasmática (PRA). Esto puede ser problemático para la terapia con inhibidores de la ECA y antagonistas de los receptores de angiotensina II, ya que el aumento de PRA podría superar parcialmente la inhibición farmacológica de la cascada del SRAA. Debido a que los inhibidores de la renina afectan directamente la actividad de la renina, la disminución de la PRA a pesar del aumento de la PRC (por la pérdida de la retroalimentación negativa) puede ser clínicamente ventajosa. [28]
La pepstatina fue el primer inhibidor sintético de la renina. Es de origen microbiano y es un N-acil-pentapéptido, más exactamente: isovaleril-L-valil-L-valil-estatil-L-alanil-estatina. [8] [29] Se descubrió que la pepstatina es un potente inhibidor competitivo de la mayoría de las proteasas aspárticas, pero un inhibidor débil de la renina. [30] Originalmente, se pensó que era eficaz en el tratamiento de las úlceras duodenales y pasó por ensayos clínicos, pero no tuvo éxito. [31] [32] Se cree que la estatina , un aminoácido , es responsable de la actividad inhibidora de la pepstatina, porque imita el estado de transición tetraédrico de la catálisis peptídica . [33] Debido a las propiedades hidrofóbicas de la estatina, la pepstatina tiene una solubilidad muy baja en medios fisiológicos. [34] Dado que tenía baja potencia y escasa solubilidad, no entró en estudios in vivo .

Esta generación consta de dos grupos de compuestos, ya sea análogos peptídicos del prosegmento de renina [35] o análogos peptídicos de la parte amino terminal del sustrato angiotensinógeno. [13] [36] [37] Los fármacos del último grupo parecían ser eficaces para inhibir la actividad de la renina y reducir la presión arterial tanto en animales como en humanos. [38] Desafortunadamente, tuvieron que administrarse por vía parenteral debido a su escasa biodisponibilidad. También resultó que tenían una duración de acción corta, potencias bajas y su capacidad para reducir la presión arterial era inadecuada. Ninguno de estos medicamentos completó investigaciones clínicas. [28]

Los compuestos de esta generación eran más potentes, más estables y tenían una duración de acción más prolongada. Uno de ellos, CGP2928, un compuesto peptidomimético , fue el primer inhibidor de la renina que demostró ser eficaz cuando se toma por vía oral. Probado en titíes , sólo resultó activo en dosis elevadas. [12] El desarrollo de nuevos fármacos de segunda generación continuó mejorando las propiedades farmacocinéticas. Luego se descubrieron el remikiren, el enalkiren y el zankiren. Se trataba de inhibidores peptidomiméticos con estructuras mejoradas que los hacían más específicos, potentes y estables. Lamentablemente, el desarrollo clínico se interrumpió porque los fármacos tenían una biodisponibilidad oral deficiente (se absorbían mal y se metabolizaban rápidamente) y la actividad para reducir la presión arterial seguía siendo baja. [7] [22] [28]
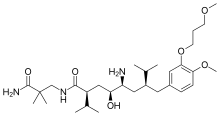
Aliskiren , un inhibidor no peptídico de renina activo por vía oral, fue el primer fármaco de su clase en el mercado. Se utiliza para tratar la hipertensión como monoterapia o en combinación con otros agentes antihipertensivos. [7] [39] La clave para el descubrimiento del aliskiren fue la cristalografía y las técnicas de modelado molecular . Ahora se ha encontrado una solución al problema que impedía el desarrollo de los inhibidores de renina de las generaciones anteriores. Se sabía que las sustancias no peptídicas podían resolver los problemas de propiedades farmacocinéticas deficientes y especificidad baja. Esto llevó al diseño de pequeñas moléculas, inhibidores no peptídicos, que eran muy potentes y específicos de la renina humana. [22] [40]
Sin embargo, debido a su estructura química, incluso los inhibidores de la renina de tercera generación son difíciles de reabsorber por el cuerpo humano y su biodisponibilidad oral suele ser inferior al 2%.
La molécula de renina es una enzima monoespecífica que pertenece a la familia de las proteasas aspárticas. [41] Su estructura es compleja y consta de dos lóbulos homólogos que se pliegan principalmente en una conformación de lámina β . [22] Entre los dos lóbulos, en lo profundo de la enzima, se encuentra el sitio activo , y su actividad catalítica se debe a dos residuos de ácido aspártico (Asp32 y Asp 215, uno de cada lóbulo de la molécula de renina). [42] Un colgajo flexible hecho de aminoácidos formados en una horquilla β cierra el sitio activo cubriendo la hendidura. [43] La molécula de renina contiene aminoácidos hidrofóbicos e hidrofílicos . Los hidrofílicos tienden a estar en el exterior de la molécula, mientras que los hidrofóbicos tienden a estar más en el interior y forman el sitio activo, una gran cavidad hidrofóbica [44] que puede acomodar un ligando con al menos siete residuos. La conexión principal entre un ligando y la enzima es mediante enlaces de hidrógeno . Los residuos reciben el nombre de su lugar en el ligando, los residuos más cercanos al sitio de escisión se denominan P1 y P1' y se unen a las bolsas S1 y S1', respectivamente. Hay cuatro bolsillos S y tres bolsillos S′ (tabla 1). Los bolsillos se alternan a cada lado de la columna vertebral del ligando. Esta alternancia afecta la orientación de los bolsillos, haciendo que los bolsillos S3 y S1 se dispongan juntos y el bolsillo S2 cerca de los bolsillos S4 y S1'. [43] La evidencia sugiere que los bolsillos S1 y S3, dispuestos estrechamente, se fusionan para formar un superbolsillo espacioso. [45] Los ligandos que llenan el superbolsillo tienen mayor potencia que los que no lo hacen, y su ocupación aumenta la potencia 200 veces. Estos ligandos pueden ser estructuralmente diversos y formar enlaces de van der Waals con la superficie del superbolsillo. [11] Desde el bolsillo S3 se extiende un sitio de unión distinto para la renina, el subbolsillo S3 sp . [41] El subbolsillo S3 sp puede acomodar residuos hidrofóbicos y polares , el bolsillo puede acomodar tres moléculas de agua, pero también tiene una naturaleza lipófila . El S3 sp.El subbolsillo no es conformacionalmente flexible, por lo que los residuos que ocupan el bolsillo deben tener ciertas características. No pueden ser estéricamente exigentes y deben tener un número razonablemente alto de enlaces giratorios y poder conectarse con enlaces de hidrógeno. El bolsillo S2 es grande, bipartito e hidrofóbico, pero puede acomodar ligandos tanto hidrofóbicos como polares. Esta diversidad de polaridades posibles ofrece al residuo P2 la oportunidad de variar en su conexión con la enzima. Los subbolsillos S3-S1 y S3 sp han sido el principal objetivo del diseño de fármacos, pero descubrimientos recientes han indicado otros sitios de interés. Se ha demostrado que las interacciones con las bolsas en el sitio S' son críticas para la afinidad , especialmente las S1' y S2', y las pruebas in vitro han indicado que la interacción con la región del colgajo podría ser importante para la afinidad. [11]

La interacción con ambos ácidos aspártico en el sitio activo da como resultado una mayor afinidad. También se obtiene una mayor afinidad al ocupar zonas más activas del sitio. Sin embargo, algunos bolsillos contribuyen más a la afinidad que otros. Una interacción hidrofóbica con el subbolsillo S3 sp , S1 y S3 contribuye a una mayor potencia y afinidad. [47] Al tener un residuo grande y aromático en P3 aumenta la actividad inhibidora. [48] La ocupación del subbolsillo S3 sp puede aumentar la potencia 50 veces y produce una unión estrecha. [11]
Ejemplo de unión al inhibidor de renina: Aliskiren es un inhibidor de renina similar a un péptido y, a diferencia de la mayoría, es bastante hidrófilo. Bloquea la función catalítica de la enzima ocupando los bolsillos S3 a S2′, excepto el bolsillo S2. Aliskiren también se une al subbolsillo S3 sp y debido a que ese bolsillo es distinto para la renina, el aliskiren no inhibe otras proteasas aspárticas, como la catepsina D y la pepsina . [46] La cadena lateral de aliskiren se une idealmente al subbolsillo S3 sp y conduce a su calidad como inhibidor de la renina humana. [11] El grupo hidroxilo del aliskiren forma un enlace de hidrógeno con ambos átomos de oxígeno del Asp 32. El grupo amina forma un enlace de hidrógeno con el grupo ácido carboxílico de Gly 217 y el átomo de oxígeno del Asp32. El grupo metoxi en el anillo aromático llena el bolsillo S3 y posiblemente pueda formar un enlace de hidrógeno con un grupo amino secundario de Tyr 14. El grupo amida forma un enlace de hidrógeno con un grupo amino secundario de Ser 76. [47] El S1 y el S1 ′ los bolsillos están ocupados por los dos grupos propilo en las posiciones P1 y P1′. [45] La amida terminal en la posición P2' ancla la cola de amida en el sitio activo formando un enlace de hidrógeno con Arg 74 en el bolsillo S2'. [49]
Aliskiren es eficaz para reducir la presión arterial, [7] [28] pero a partir del 20 de abril de 2012, la Administración de Alimentos y Medicamentos de EE. UU. (FDA) emitió una advertencia sobre posibles riesgos al usar aliskiren o medicamentos para la presión arterial que contengan aliskiren con inhibidores de la ECA y receptores de angiotensina. bloqueadores (BRA) en pacientes con diabetes o insuficiencia renal (renal). Aconsejaron que tales combinaciones de medicamentos no deben usarse en pacientes con diabetes debido al riesgo de causar insuficiencia renal, hipotensión e hiperpotasemia y que aliskiren no debe usarse con ARAII o inhibidores de la ECA en pacientes con insuficiencia renal de moderada a grave (es decir, donde la tasa de filtración glomerular [TFG] <60 ml/min). Sin embargo, también recomiendan que los pacientes no dejen de tomar aliskiren sin consultar con un profesional de la salud. [50]
Aliskiren en combinación con hidroclorotiazida fue aprobado por la FDA en 2008 con el nombre comercial Tekturna HCT. [51] [52]
En 2007, las empresas Actelion/Merck y Speedel anunciaron que tenían la próxima generación de inhibidores de renina en investigación clínica. El compuesto líder de Actelion/Merck ha entrado en la fase II de ensayos. Un compuesto de Speedel, el SPP635, ha completado la fase IIa. Los resultados mostraron que era seguro y bien tolerado durante un período de cuatro semanas, y redujo la presión arterial entre 9,8 y 17,9 mmHg. En 2008, SPP635 continuaba el desarrollo de la fase II para la hipertensión en pacientes diabéticos . Se encuentran en ensayos clínicos más inhibidores de la renina de Speedel. Dos de ellos, SPP1148 y SPP676, han entrado en fase I. Otros se encuentran en fases preclínicas , el compuesto SPP1234 y compuestos de la serie SPP800. [51]
La próxima generación de inhibidores de la renina ha mostrado mejoras potenciales con respecto a las generaciones anteriores, donde la biodisponibilidad ha aumentado hasta un 30% en humanos y tienen una mejor distribución en los tejidos . [51] [ fuente no confiable ]