.jpg/440px-Photodynamic_therapy_(red).jpg)
Los fotosensibilizadores son absorbentes de luz que alteran el curso de una reacción fotoquímica . Por lo general, son catalizadores . [1] Pueden funcionar mediante muchos mecanismos, a veces donan un electrón al sustrato, a veces extraen un átomo de hidrógeno del sustrato. Al final de este proceso, el fotosensibilizador regresa a su estado fundamental , donde permanece químicamente intacto, listo para absorber más luz. [2] [3] [4] Una rama de la química que utiliza con frecuencia fotosensibilizadores es la química de polímeros , utilizando fotosensibilizadores en reacciones como la fotopolimerización , la fotorreticulación y la fotodegradación . [5] Los fotosensibilizadores también se utilizan para generar estados electrónicos excitados prolongados en moléculas orgánicas con usos en fotocatálisis , conversión ascendente de fotones y terapia fotodinámica . Generalmente, los fotosensibilizadores absorben la radiación electromagnética que consiste en radiación infrarroja , radiación de luz visible y radiación ultravioleta y transfieren la energía absorbida a las moléculas vecinas. Esta absorción de luz es posible gracias a los grandes sistemas π deslocalizados de los fotosensibilizadores , que reducen la energía de los orbitales HOMO y LUMO para promover la fotoexcitación . Si bien muchos fotosensibilizadores son compuestos orgánicos u organometálicos, también existen ejemplos de uso de puntos cuánticos semiconductores como fotosensibilizadores. [6]

Los fotosensibilizadores absorben luz (hν) y transfieren la energía de la luz incidente a otra molécula cercana, ya sea directamente o mediante una reacción química. Al absorber fotones de radiación de la luz incidente, los fotosensibilizadores se transforman en un estado singlete excitado . El electrón único en el estado singlete excitado luego cambia a su estado de espín intrínseco a través del cruce entre sistemas para convertirse en un estado triplete excitado . Los estados triplete suelen tener vidas más largas que los singletes excitados. La vida prolongada aumenta la probabilidad de interactuar con otras moléculas cercanas. Los fotosensibilizadores experimentan distintos niveles de eficiencia para el cruce entre sistemas en diferentes longitudes de onda de luz según la estructura electrónica interna de la molécula. [2] [7]
Para que una molécula sea considerada fotosensibilizadora:
Es importante diferenciar los fotosensibilizadores de otras interacciones fotoquímicas , incluyendo, pero no limitado a, fotoiniciadores , fotocatalizadores , fotoácidos y fotopolimerización . Los fotosensibilizadores utilizan luz para realizar un cambio químico en un sustrato; después del cambio químico, el fotosensibilizador vuelve a su estado inicial, permaneciendo químicamente inalterado del proceso. Los fotoiniciadores absorben luz para convertirse en una especie reactiva, comúnmente un radical o un ion , donde luego reacciona con otra especie química. Estos fotoiniciadores a menudo se modifican químicamente por completo después de su reacción. Los fotocatalizadores aceleran las reacciones químicas que dependen de la luz. Si bien algunos fotosensibilizadores pueden actuar como fotocatalizadores, no todos los fotocatalizadores pueden actuar como fotosensibilizadores. Los fotoácidos (o fotobases) son moléculas que se vuelven más ácidas (o básicas) al absorber luz. Los fotoácidos aumentan su acidez al absorber luz y se reasocian térmicamente a su forma original al relajarse. Los generadores de fotoácidos sufren un cambio irreversible para convertirse en una especie ácida tras la absorción de luz. La fotopolimerización puede ocurrir de dos maneras. La fotopolimerización puede ocurrir directamente, en la que los monómeros absorben la luz incidente y comienzan a polimerizarse, o puede ocurrir a través de un proceso mediado por un fotosensibilizador, en el que el fotosensibilizador absorbe primero la luz antes de transferir energía a la especie monomérica. [8] [9]
Los fotosensibilizadores han existido en los sistemas naturales desde que la clorofila y otras moléculas sensibles a la luz han formado parte de la vida vegetal, pero los estudios sobre los fotosensibilizadores comenzaron a principios del siglo XX, cuando los científicos observaron la fotosensibilidad en sustratos biológicos y en el tratamiento del cáncer. Los estudios mecanicistas relacionados con los fotosensibilizadores comenzaron con los científicos que analizaban los resultados de las reacciones químicas en las que los fotosensibilizadores fotooxidaban el oxígeno molecular en especies de peróxido. Los resultados se comprendieron calculando las eficiencias cuánticas y los rendimientos fluorescentes en distintas longitudes de onda de la luz y comparando estos resultados con el rendimiento de las especies reactivas del oxígeno . Sin embargo, no fue hasta la década de 1960 que se confirmó el mecanismo de donación de electrones a través de varios métodos espectroscópicos , incluidos los estudios de reacción intermedia y los estudios de luminiscencia . [8] [10] [11]
El término fotosensibilizador no aparece en la literatura científica hasta la década de 1960. En su lugar, los científicos se referían a los fotosensibilizadores como sensibilizadores utilizados en procesos de fotooxidación o fotooxigenación. Los estudios durante este período de tiempo que involucraban fotosensibilizadores utilizaban fotosensibilizadores orgánicos, que consistían en moléculas de hidrocarburos aromáticos , que podían facilitar las reacciones de química sintética. Sin embargo, en las décadas de 1970 y 1980, los fotosensibilizadores ganaron atractivo en la comunidad científica por su papel dentro de los procesos biológicos y enzimáticos. [12] [13] Actualmente, los fotosensibilizadores se estudian por sus contribuciones a campos como la recolección de energía, la catálisis fotorredox en la química sintética y el tratamiento del cáncer. [11] [14]
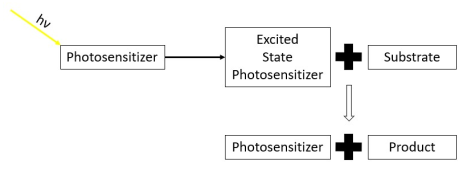
Existen dos vías principales para las reacciones fotosensibilizadas. [15]
En las reacciones fotosensibilizadas de tipo I, el fotosensibilizador se excita mediante una fuente de luz hasta alcanzar un estado triplete. El fotosensibilizador excitado en estado triplete reacciona entonces con una molécula de sustrato que no es oxígeno molecular para formar un producto y reformar el fotosensibilizador. Las reacciones fotosensibilizadas de tipo I dan lugar a que el fotosensibilizador se extinga mediante un sustrato químico diferente al oxígeno molecular. [2] [16]

En las reacciones fotosensibilizadas de tipo II, el fotosensibilizador se excita mediante una fuente de luz hasta alcanzar un estado triplete. A continuación, el fotosensibilizador excitado reacciona con una molécula de oxígeno triplete en estado fundamental . Esto excita la molécula de oxígeno hasta alcanzar el estado singlete, lo que la convierte en una especie reactiva de oxígeno . Tras la excitación, la molécula de oxígeno singlete reacciona con un sustrato para formar un producto. La reacción fotosensibilizada de tipo II da como resultado que el fotosensibilizador se extinga mediante una molécula de oxígeno en estado fundamental que luego reacciona con un sustrato para formar un producto. [2] [17] [18]
Los fotosensibilizadores pueden clasificarse en tres dominios generalizados según su estructura molecular. Estos tres dominios son los fotosensibilizadores organometálicos, los fotosensibilizadores orgánicos y los fotosensibilizadores de nanomateriales.


Los fotosensibilizadores organometálicos contienen un átomo de metal quelado con al menos un ligando orgánico . Las capacidades fotosensibilizadoras de estas moléculas resultan de interacciones electrónicas entre el metal y el ligando(s). Los centros metálicos ricos en electrones populares para estos complejos incluyen Iridio , Rutenio y Rodio . Estos metales, así como otros, son centros metálicos comunes para fotosensibilizadores debido a sus orbitales d altamente llenos , o altos conteos de electrones d , para promover la transferencia de carga del metal al ligando desde ligandos aceptores de electrones pi. Esta interacción entre el centro metálico y el ligando conduce a un gran continuo de orbitales dentro del orbital molecular ocupado más alto (HOMO) y el orbital molecular desocupado más bajo (LUMO) que permite que los electrones excitados cambien multiplicidades a través del cruce entre sistemas. [19]
Si bien muchos compuestos fotosensibilizadores organometálicos se elaboran de forma sintética, también existen fotosensibilizadores organometálicos naturales que captan la luz . Algunos ejemplos relevantes de fotosensibilizadores organometálicos naturales incluyen la clorofila A y la clorofila B. [19] [20]
Los fotosensibilizadores orgánicos son moléculas basadas en carbono que son capaces de fotosensibilizar. Los primeros fotosensibilizadores estudiados fueron hidrocarburos aromáticos que absorbían luz en presencia de oxígeno para producir especies reactivas de oxígeno. [21] Estos fotosensibilizadores orgánicos están formados por sistemas altamente conjugados que promueven la deslocalización de electrones . Debido a su alta conjugación, estos sistemas tienen una brecha más pequeña entre el orbital molecular ocupado más alto (HOMO) y el orbital molecular desocupado más bajo (LUMO), así como un continuo de orbitales dentro del HOMO y LUMO. La brecha de banda más pequeña y el continuo de orbitales tanto en la banda de conducción como en la banda de valencia permiten que estos materiales entren en su estado triplete de manera más eficiente, lo que los convierte en mejores fotosensibilizadores. Algunos fotosensibilizadores orgánicos notables que se han estudiado ampliamente incluyen benzofenonas, azul de metileno, rosa de Bengala, flavinas, pterinas [22] y otros. [23]
Los puntos cuánticos coloidales son materiales semiconductores a escala nanométrica con propiedades ópticas y electrónicas altamente ajustables. Los puntos cuánticos fotosensibilizadores a través del mismo mecanismo que los fotosensibilizadores organometálicos y orgánicos, pero sus propiedades a escala nanométrica permiten un mayor control en aspectos distintivos. Algunas ventajas clave del uso de puntos cuánticos como fotosensibilizadores incluyen su pequeña brecha de banda ajustable que permite transiciones eficientes al estado triplete y su insolubilidad en muchos solventes que permite una fácil recuperación de una mezcla de reacción sintética. [18]
Las nanobarras , de tamaño similar a los puntos cuánticos, tienen propiedades ópticas y electrónicas ajustables. En función de su tamaño y composición del material, es posible ajustar el pico máximo de absorción de las nanobarras durante su síntesis. Este control ha llevado a la creación de nanobarras fotosensibilizadoras. [24]
La terapia fotodinámica utiliza fotosensibilizadores de tipo II para captar luz con el fin de degradar tumores o masas cancerosas. Este descubrimiento fue observado por primera vez en 1907 por Hermann von Tappeiner cuando utilizó eosina para tratar tumores de la piel. [11] El proceso fotodinámico es predominantemente una técnica no invasiva en la que los fotosensibilizadores se colocan dentro de un paciente para que se acumulen en el tumor o cáncer. Cuando el fotosensibilizador llega al tumor o cáncer, se proyecta una luz de longitud de onda específica en el exterior del área afectada del paciente. Esta luz (preferiblemente de frecuencia cercana al infrarrojo , ya que permite la penetración de la piel sin toxicidad aguda) excita los electrones del fotosensibilizador al estado triplete. Tras la excitación, el fotosensibilizador comienza a transferir energía al oxígeno triplete del estado fundamental vecino para generar oxígeno singlete excitado . Las especies de oxígeno excitadas resultantes degradan selectivamente el tumor o la masa cancerosa. [24] [25] [17]
En febrero de 2019, los científicos médicos anunciaron que el iridio unido a la albúmina , creando una molécula fotosensibilizada, puede penetrar las células cancerosas y, después de ser irradiado con luz (un proceso llamado terapia fotodinámica ), destruir las células cancerosas. [26] [27]

En 1972, los científicos descubrieron que la clorofila podía absorber la luz solar y transferir energía a las células electroquímicas. [28] Este descubrimiento condujo finalmente al uso de fotosensibilizadores como materiales de recolección de luz solar en células solares, principalmente mediante el uso de tintes fotosensibilizadores. Las células solares sensibilizadas con tinte utilizan estos tintes fotosensibilizadores para absorber fotones de la luz solar y transferir electrones ricos en energía al material semiconductor vecino para generar energía eléctrica de salida. Estos tintes actúan como dopantes para las superficies de los semiconductores, lo que permite la transferencia de energía luminosa del fotosensibilizador a energía electrónica dentro del semiconductor. Estos fotosensibilizadores no se limitan a los tintes. Pueden tomar la forma de cualquier estructura fotosensibilizadora, dependiendo del material semiconductor al que estén unidos. [16] [14] [29] [30]
Mediante la absorción de luz, los fotosensibilizadores pueden utilizar la transferencia de estado triplete para reducir moléculas pequeñas, como el agua, y generar gas hidrógeno. Hasta el momento, los fotosensibilizadores han generado gas hidrógeno al dividir moléculas de agua a pequeña escala de laboratorio. [31] [32]
A principios del siglo XX, los químicos observaron que varios hidrocarburos aromáticos en presencia de oxígeno podían absorber luz de longitud de onda específica para generar una especie de peróxido. [12] Este descubrimiento de la reducción del oxígeno por un fotosensibilizador llevó a los químicos a estudiar los fotosensibilizadores como catalizadores fotorredox por sus funciones en la catálisis de reacciones pericíclicas y otras reacciones de reducción y oxidación . Los fotosensibilizadores en química sintética permiten la manipulación de transiciones electrónicas dentro de las moléculas a través de una fuente de luz aplicada externamente. Estos fotosensibilizadores utilizados en química redox pueden ser orgánicos, organometálicos o nanomateriales dependiendo de las propiedades físicas y espectrales requeridas para la reacción. [16] [23]
Los fotosensibilizadores que se incorporan fácilmente a los tejidos externos pueden aumentar la velocidad a la que se generan especies reactivas de oxígeno tras la exposición a la luz ultravioleta (como la luz solar que contiene rayos ultravioleta). Algunos agentes fotosensibilizadores, como la hierba de San Juan, parecen aumentar la incidencia de afecciones cutáneas inflamatorias en animales y se ha observado que reducen ligeramente la dosis mínima de bronceado en humanos. [33] [34]
Algunos ejemplos de medicamentos fotosensibilizantes (tanto en investigación como aprobados para uso humano) son: