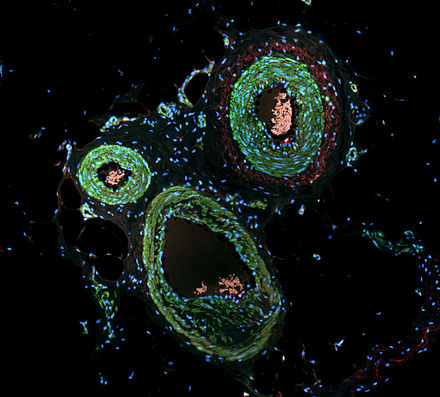
La inmunofluorescencia (IF) es una técnica basada en microscopía óptica que permite la detección y localización de una amplia variedad de biomoléculas objetivo dentro de una célula o tejido a nivel cuantitativo. La técnica utiliza la especificidad de unión de anticuerpos y antígenos . [1] La región específica que un anticuerpo reconoce en un antígeno se llama epítopo . Varios anticuerpos pueden reconocer el mismo epítopo pero difieren en su afinidad de unión. El anticuerpo con mayor afinidad por un epítopo específico superará a los anticuerpos con menor afinidad por el mismo epítopo. [2] [3]
Al conjugar el anticuerpo con un fluoróforo , la posición de la biomolécula objetivo se visualiza excitando el fluoróforo y midiendo la emisión de luz en una longitud de onda específica predefinida usando un microscopio de fluorescencia . Es imperativo que la unión del fluoróforo al propio anticuerpo no interfiera con la especificidad inmunológica del anticuerpo o la capacidad de unión de su antígeno. [4] [5]
La inmunofluorescencia es un ejemplo ampliamente utilizado de inmunotinción (el uso de anticuerpos para teñir proteínas) y es un ejemplo específico de inmunohistoquímica (el uso de la relación anticuerpo-antígeno en los tejidos). Esta técnica utiliza principalmente fluoróforos para visualizar la ubicación de los anticuerpos, mientras que otras provocan un cambio de color en el entorno que contiene el antígeno de interés o utilizan una etiqueta radiactiva. Las técnicas de inmunofluorescencia que utilizaban anticuerpos marcados fueron conceptualizadas en la década de 1940 por Albert H. Coons . [2] [6] [7]

La inmunofluorescencia se emplea en investigaciones científicas fundamentales y esfuerzos de diagnóstico clínico, lo que demuestra su utilidad multifacética en diversos sustratos, incluidas secciones de tejido, líneas celulares cultivadas o células individuales. Su uso incluye el análisis de la distribución de proteínas , glicanos , pequeñas moléculas biológicas y no biológicas y la visualización de estructuras como filamentos de tamaño intermedio. [8]
Si la topología de una membrana celular es indeterminada, la inserción de epítopos en proteínas se puede utilizar junto con la inmunofluorescencia para determinar las estructuras dentro de la membrana celular. [9] La inmunofluorescencia (IF) también se puede utilizar como método "semicuantitativo" para obtener información sobre los niveles y patrones de localización de la metilación del ADN. IF también se puede utilizar en combinación con otros métodos de tinción fluorescente sin anticuerpos, por ejemplo, el uso de DAPI para marcar el ADN . [10] [11]
El examen de muestras de inmunofluorescencia se puede realizar utilizando varias configuraciones de microscopio, incluido el microscopio de epifluorescencia , el microscopio confocal y el microscopio de campo amplio. [12]

Para realizar la tinción por inmunofluorescencia, se debe conjugar (“marcar”) un fluoróforo con un anticuerpo. Los procedimientos de tinción se pueden aplicar tanto a anticuerpos expresados intracelularmente retenidos como a antígenos de la superficie celular en células vivas. Hay dos clases generales de técnicas de inmunofluorescencia: primaria (directa) y secundaria (indirecta). [1] [2] Las siguientes descripciones se centrarán principalmente en estas clases en términos de anticuerpos conjugados. [12]

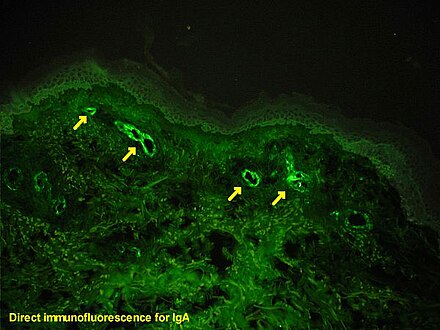
La inmunofluorescencia primaria (directa) (DIF) utiliza un único anticuerpo, conjugado con un fluoróforo . El anticuerpo reconoce la molécula objetivo (antígeno) y se une a una región específica, llamada epítopo . El fluoróforo adherido se puede detectar mediante microscopía fluorescente que, según el tipo de fluoróforo, emitirá una longitud de onda de luz específica una vez excitado. [1] [14]
La unión directa del fluoróforo al anticuerpo reduce la cantidad de pasos en el procedimiento de preparación de la muestra, lo que ahorra tiempo y reduce la señal de fondo no específica durante el análisis. [12] Esto también limita la posibilidad de reactividad cruzada de anticuerpos y posibles errores durante todo el proceso. Una desventaja del DIF es la cantidad limitada de anticuerpos que pueden unirse al antígeno. Esta limitación puede reducir la sensibilidad a la técnica. Cuando la proteína objetivo está disponible sólo en pequeñas concentraciones, un mejor enfoque sería la IF secundaria, que se considera más sensible que la DIF [2] [12] en comparación con la inmunofluorescencia secundaria (indirecta). [1]

La inmunofluorescencia secundaria (indirecta) (SIF) es similar a la inmunofluorescencia directa, sin embargo, la técnica utiliza dos tipos de anticuerpos, mientras que solo uno de ellos tiene un fluoróforo conjugado. El anticuerpo con el fluoróforo conjugado se denomina anticuerpo secundario, mientras que el no conjugado se denomina anticuerpo primario. [1]
El principio de esta técnica es que el anticuerpo primario se une específicamente al epítopo de la molécula diana, mientras que el anticuerpo secundario, con el fluoróforo conjugado, reconoce y se une al anticuerpo primario. [1]
Esta técnica se considera más sensible que la inmunofluorescencia primaria, porque múltiples anticuerpos secundarios pueden unirse al mismo anticuerpo primario. El mayor número de moléculas de fluoróforo por antígeno aumenta la cantidad de luz emitida y, por tanto, amplifica la señal. [1] Existen diferentes métodos para lograr una mayor proporción fluoróforo-antígeno, como el complejo avidina-biotina (método ABC) y estreptavidina-biotina marcada (método LSAB). [15] [16]

La inmunofluorescencia sólo se limita a células fijas (es decir, muertas) cuando se estudian estructuras dentro de la célula, ya que los anticuerpos generalmente no penetran las membranas celulares o subcelulares intactas en las células vivas, porque son proteínas de gran tamaño. Para visualizar estas estructuras, el material antigénico debe fijarse firmemente en su localización natural dentro de la célula. [17] Para estudiar estructuras dentro de células vivas, en combinación con fluorescencia, se pueden utilizar proteínas recombinantes que contengan dominios de proteínas fluorescentes, por ejemplo, proteína verde fluorescente (GFP). La técnica GFP implica alterar la información genética de las células. [18] [19]
Un problema importante con la inmunofluorescencia es el fotoblanqueo , [12] la pérdida permanente de la capacidad de los fluoróforos para emitir luz. [1] Para mitigar el riesgo de fotoblanqueo se pueden emplear diferentes estrategias. Al reducir o limitar la intensidad o el tiempo de exposición a la luz, se reduce el ciclo de absorción-emisión de la luz fluorescente, preservando así la funcionalidad de los fluoróforos. También se puede aumentar la concentración de fluoróforos u optar por fluoróforos más robustos que muestren resistencia al fotoblanqueo, como Alexa Fluors , Seta Fluors o DyLight Fluors . [2]

Otros problemas que pueden surgir al utilizar técnicas de inmunofluorescencia incluyen la autofluorescencia , la superposición espectral y la tinción no específica. [1] [2] La autofluorescencia incluye la fluorescencia natural emitida por el tejido o la propia célula de la muestra. La superposición espectral ocurre cuando un fluoróforo tiene un espectro de emisión amplio, que se superpone con el espectro de otro fluoróforo, dando lugar a señales falsas. La tinción no específica se produce cuando el anticuerpo que contiene el fluoróforo se une a proteínas no deseadas debido a una similitud suficiente en el epítopo. Esto puede dar lugar a falsos positivos. [2] [4] [1]
Las principales mejoras de la inmunofluorescencia residen en el desarrollo de fluoróforos y microscopios fluorescentes. Los fluoróforos se pueden modificar estructuralmente para mejorar el brillo y la fotoestabilidad, preservando al mismo tiempo las propiedades espectrales y la permeabilidad celular. [20]
Los métodos de microscopía de fluorescencia de superresolución pueden producir imágenes con una resolución más alta que los microscopios impuestos por el límite de difracción . Esto permite la determinación de detalles estructurales dentro de la celda. [21] La superresolución en fluorescencia, más específicamente, se refiere a la capacidad de un microscopio para evitar la fluorescencia simultánea de fluoróforos espectralmente idénticos adyacentes (superposición espectral). Algunos de los métodos de microscopio fluorescente de superresolución desarrollados recientemente incluyen la microscopía de agotamiento de emisiones estimuladas ( STED ), la microscopía de iluminación estructurada saturada (SSIM), la microscopía de localización de fotoactivación de fluorescencia (F PALM ) y la microscopía de reconstrucción óptica estocástica (STORM). [22]