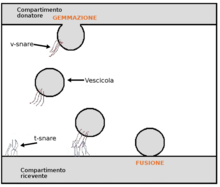
La transcitosis (también conocida como citopepsia ) [1] es un tipo de transporte transcelular en el que se transportan varias macromoléculas a través del interior de una célula . Las macromoléculas son capturadas en vesículas en un lado de la célula, arrastradas a través de la célula y expulsadas en el otro lado. Los ejemplos de macromoléculas transportadas incluyen IgA , [2] transferrina , [3] e insulina . [4] Si bien la transcitosis se observa más comúnmente en las células epiteliales , el proceso también está presente en otras partes. Los capilares sanguíneos son un sitio bien conocido para la transcitosis, [5] aunque ocurre en otras células, incluidas las neuronas , [6] los osteoclastos [7] y las células M del intestino . [8]
La regulación de la transcitosis varía en gran medida debido a los muchos tejidos diferentes en los que se observa este proceso. Se han identificado varios mecanismos de transcitosis específicos de tejido. Se ha demostrado que la brefeldina A , un inhibidor comúnmente utilizado del transporte del RE al aparato de Golgi , inhibe la transcitosis en células de riñón de perro, lo que proporcionó las primeras pistas sobre la naturaleza de la regulación de la transcitosis. [9] También se ha demostrado que la transcitosis en células de riñón de perro está regulada en la membrana apical por Rab17 , [10] así como por Rab11a y Rab25 . [11] Trabajos posteriores en células de riñón de perro han demostrado que una cascada de señalización que involucra la fosforilación de EGFR por Yes que conduce a la activación de Rab11FIP5 por MAPK1 regula positivamente la transcitosis. [12] Se ha demostrado que la transcitosis está inhibida por la combinación de progesterona y estradiol seguida de la activación mediada por prolactina en la glándula mamaria del conejo durante el embarazo . [13] En la tiroides , la transcitosis de células foliculares está regulada positivamente por la TSH [ cita requerida ] . Se ha demostrado que la fosforilación de caveolina 1 inducida por peróxido de hidrógeno es crítica para la activación de la transcitosis en el tejido vascular pulmonar . [14] Por lo tanto, se puede concluir que la regulación de la transcitosis es un proceso complejo que varía entre tejidos.
Debido a la función de la transcitosis como un proceso que transporta macromoléculas a través de las células, puede ser un mecanismo conveniente por el cual los patógenos pueden invadir un tejido. Se ha demostrado que la transcitosis es fundamental para la entrada de Cronobacter sakazakii a través del epitelio intestinal, así como la barrera hematoencefálica . [15] Se ha demostrado que Listeria monocytogenes ingresa al lumen intestinal a través de la transcitosis a través de las células caliciformes . [16] Se ha demostrado que la toxina Shiga secretada por E. coli enterohemorrágica se transcita en el lumen intestinal. [17] A partir de estos ejemplos, se puede decir que la transcitosis es vital para el proceso de patogénesis de una variedad de agentes infecciosos.
Las compañías farmacéuticas, como Lundbeck , están explorando actualmente el uso de la transcitosis como un mecanismo para transportar medicamentos terapéuticos a través de la barrera hematoencefálica (BHE) humana. [ cita requerida ] Explotar el propio mecanismo de transporte del cuerpo puede ayudar a superar la alta selectividad de la BHE, que normalmente bloquea la absorción de la mayoría de los anticuerpos terapéuticos en el cerebro y el sistema nervioso central (SNC). La compañía farmacéutica Genentech , después de haber sintetizado un anticuerpo terapéutico que inhibía eficazmente la función enzimática de BACE1 , experimentó problemas para transferir niveles adecuados y eficientes del anticuerpo dentro del cerebro. BACE1 es la enzima que procesa las proteínas precursoras amiloide en péptidos amiloide-β , incluidas las especies que se agregan para formar placas amiloides asociadas con la enfermedad de Alzheimer . [ cita requerida ]
Las moléculas se transportan a través de una barrera epitelial o endotelial por una de dos rutas: 1) una ruta transcelular a través del compartimento intracelular de la célula, o 2) una ruta paracelular a través del espacio extracelular entre células adyacentes. [18] La ruta transcelular también se llama transcitosis. La transcitosis puede estar mediada por receptores y consta de tres pasos: 1) endocitosis mediada por receptores de la molécula en un lado de la célula, por ejemplo, el lado luminal; 2) movimiento de la molécula a través del compartimento intracelular, típicamente dentro del sistema endosómico; y 3) exocitosis de la molécula al espacio extracelular en el otro lado de la célula, por ejemplo, el lado abluminal.
La transcitosis puede ser unidireccional o bidireccional. La transcitosis unidireccional puede ocurrir selectivamente en la dirección luminal a abluminal, o en la dirección inversa, en la dirección abluminal a luminal.
La transcitosis es importante en el transporte microvascular de péptidos y proteínas en el cerebro, [19] porque el endotelio microvascular del cerebro, que forma la barrera hematoencefálica (BHE) in vivo, expresa uniones estrechas únicas, similares a las epiteliales, de alta resistencia . [20] Las uniones estrechas endoteliales del cerebro prácticamente eliminan la vía paracelular de transporte de solutos a través de la pared endotelial microvascular en el cerebro. Por el contrario, la barrera endotelial en los órganos periféricos no expresa uniones estrechas, y el movimiento de solutos a través de la vía paracelular es prominente en la barrera endotelial en órganos distintos del cerebro o la médula espinal. [21]
La transcitosis mediada por receptores, o RMT, a través de la BHE es una vía potencial para la administración de fármacos al cerebro , en particular para fármacos biológicos como las proteínas recombinantes. [22] El fármaco no transportable, o proteína terapéutica, está fusionado genéticamente a una proteína transportadora. La proteína transportadora puede ser un péptido endógeno, o anticuerpo monoclonal peptidomimético, que experimenta RMT a través de la BHE mediante el transporte en receptores endoteliales cerebrales como el receptor de insulina o el receptor de transferrina. La proteína transportadora actúa como un caballo de Troya molecular para transportar al cerebro la proteína terapéutica que está fusionada genéticamente a la proteína del caballo de Troya específica del receptor.
Los anticuerpos monoclonales troyanos que se dirigen a la BHE, receptor de insulina o transferrina, han estado en desarrollo de fármacos durante más de 10 años en ArmaGen, Inc., una empresa de biotecnología de Los Ángeles. ArmaGen ha desarrollado anticuerpos modificados genéticamente contra los receptores de insulina y transferrina, y ha fusionado con estos anticuerpos diferentes proteínas terapéuticas, incluyendo enzimas lisosomales, anticuerpos terapéuticos, receptores señuelo y neurotrofinas. [23] Estas proteínas terapéuticas por sí solas no cruzan la BHE, pero después de la fusión genética con el anticuerpo troyano, la proteína terapéutica penetra en la BHE a una velocidad comparable a las moléculas pequeñas. En 2015, ArmaGen será el primero en entrar en ensayos clínicos humanos con las proteínas de fusión troyano BHE que suministran fármacos proteicos al cerebro a través de la vía de la transcitosis. Las enfermedades humanas a las que se dirige inicialmente ArmaGen son enfermedades de almacenamiento lisosomal que afectan negativamente al cerebro. Las enfermedades hereditarias crean una condición en la que no se produce una enzima lisosomal específica, lo que lleva a enfermedades cerebrales graves que incluyen retraso mental, problemas de conducta y luego demencia. Aunque la enzima faltante puede ser fabricada por compañías farmacéuticas, el medicamento enzimático por sí solo no trata el cerebro, porque la enzima sola no cruza la BHE. ArmaGen ha rediseñado la enzima lisosomal faltante como una proteína de fusión de enzima-caballo de Troya que cruza la BHE. Los primeros ensayos clínicos de la nueva tecnología de proteína de fusión de caballo de Troya tratarán el cerebro en trastornos de almacenamiento lisosomal, incluida una de las enfermedades de mucopolisacaridosis tipo I (MPSIH), también llamada síndrome de Hurler , y MPS tipo II, también llamado síndrome de Hunter .
Los investigadores de Genentech propusieron la creación de un anticuerpo biespecífico que pudiera unirse a la membrana de la barrera hematoencefálica, inducir la transcitosis mediada por receptores y liberarse en el otro lado, hacia el cerebro y el sistema nervioso central. Para ello, utilizaron un anticuerpo biespecífico de ratón con dos sitios activos que desempeñaban funciones diferentes. Un brazo tenía un sitio de unión anti- receptor de transferrina de baja afinidad que induce la transcitosis. Un sitio de unión de alta afinidad haría que el anticuerpo no pudiera liberarse de la membrana de la barrera hematoencefálica después de la transcitosis. De esta manera, la cantidad de anticuerpo transportado se basa en la concentración de anticuerpo en cada lado de la barrera. El otro brazo tenía el sitio de unión anti-BACE1 de alta afinidad desarrollado previamente que inhibiría la función de BACE1 y evitaría la formación de placa amiloide. Genentech pudo demostrar en modelos de ratón que el nuevo anticuerpo biespecífico era capaz de alcanzar niveles terapéuticos en el cerebro. [24] El método de Genentech para disfrazar y transportar el anticuerpo terapéutico uniéndolo a un activador de transcitosis mediado por receptor se ha denominado el método del "Caballo de Troya".