La oxidación de Fétizon es la oxidación de alcoholes primarios y secundarios utilizando el compuesto carbonato de plata (I) absorbido en la superficie de celita, también conocido como reactivo de Fétizon , empleado por primera vez por Marcel Fétizon en 1968. [1] Es un reactivo suave, adecuado tanto para compuestos sensibles a ácidos como a bases. Su gran reactividad con lactoles hace que la oxidación de Fétizon sea un método útil para obtener lactonas a partir de un diol . La reacción se inhibe significativamente por los grupos polares dentro del sistema de reacción, así como por el impedimento estérico del α-hidrógeno del alcohol.
El reactivo de Fétizon se prepara típicamente añadiendo nitrato de plata a una solución acuosa de un carbonato, como carbonato de sodio [2] o bicarbonato de potasio [3] , mientras se agita vigorosamente en presencia de celita purificada.
Un mecanismo propuesto para la oxidación de un alcohol por el reactivo de Fétizon implica la oxidación de un solo electrón tanto del oxígeno del alcohol como del hidrógeno alfa al alcohol por dos átomos de plata (I) dentro de la superficie de celita. El ion carbonato luego procede a desprotonar el carbonilo resultante generando bicarbonato que es protonado aún más por el catión hidrógeno generado adicionalmente para provocar la eliminación de agua y la generación de dióxido de carbono . [4]

Se propone que el paso limitante de la velocidad de esta reacción sea la asociación inicial del alcohol a los iones de plata. Como resultado, la presencia de ligandos incluso débilmente asociados a la plata puede inhibir la reacción en gran medida. Como resultado, incluso los disolventes ligeramente polares de cualquier variedad, como el acetato de etilo o la metiletilcetona , se evitan cuando se utiliza este reactivo, ya que se asocian competitivamente con el reactivo. [5] Las funcionalidades polares adicionales del reactivo también deben evitarse siempre que sea posible, ya que incluso la presencia de un alqueno a veces puede reducir la reactividad de un sustrato 50 veces. [6] Los disolventes comúnmente empleados, como el benceno y el xileno, son extremadamente no polares y se puede lograr una mayor aceleración de la reacción mediante el uso del heptano más no polar . [6] El disolvente también se refluye típicamente para impulsar la reacción con calor y eliminar el agua generada por la reacción a través de la destilación azeotrópica . El impedimento estérico del hidrógeno alfa al alcohol es una determinación importante de la velocidad de oxidación, ya que afecta a la velocidad de asociación. [5] Los alcoholes terciarios que carecen de un hidrógeno alfa son seleccionados y generalmente no se oxidan en presencia del reactivo de Fétizon. [7]

Aumentar la cantidad de celita utilizada en el reactivo acelera la velocidad de la reacción al aumentar la superficie disponible para reaccionar. Sin embargo, aumentar la cantidad de celita por encima de los 900 gramos por mol de carbonato de plata (I) comienza a ralentizar la reacción debido a los efectos de dilución. [5]
El reactivo de Fétizon se utiliza principalmente en la oxidación de alcoholes primarios o secundarios a aldehídos o cetonas con una ligera selectividad hacia alcoholes secundarios [8] y alcoholes insaturados . [1] La reacción se realiza típicamente en un disolvente orgánico no polar seco a reflujo con agitación copiosa. El tiempo de reacción varía con la estructura del alcohol y normalmente se completa en tres horas. Una propiedad muy atractiva del reactivo de Fétizon es su capacidad de separarse del producto de reacción filtrándolo físicamente y lavándolo con benceno. La incapacidad del reactivo de Fétizon para oxidar alcoholes terciarios lo hace extremadamente útil en la monooxidación de un [1,2] diol en el que uno de los alcoholes es terciario mientras se evita la escisión del enlace carbono-carbono. [7]

La suavidad y sensibilidad estructural del reactivo también lo hacen ideal para la monooxidación de un diol simétrico. [8]

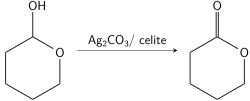
Los lactoles son extremadamente sensibles al reactivo de Fétizon, ya que se oxidan muy rápidamente a una funcionalidad de lactona. Esto permite la oxidación selectiva de los lactoles en presencia de otros alcoholes. [9] Esto también permite un uso clásico del reactivo de Fétizon para formar lactonas a partir de un diol primario. Al oxidar uno de los alcoholes a un aldehído, el segundo alcohol se equilibra con el aldehído para formar un lactol que reacciona rápidamente con más reactivo de Fétizon para atrapar el intermedio cíclico como una lactona. [8] Este método permite la síntesis de lactonas de siete miembros que tradicionalmente son más difíciles de sintetizar. [10]

Los grupos funcionales fenol pueden oxidarse a sus respectivas formas quinonas . Estas quinonas pueden acoplarse aún más dentro de la solución, lo que produce numerosas dimerizaciones según sus sustituyentes. [2]

Se ha demostrado que las aminas se oxidan en presencia del reactivo de Fétizon a enaminas [11] y cationes iminio que han quedado atrapados, [12] pero también se pueden seleccionar en contra de un compuesto con funcionalidades de alcohol que se oxidan más fácilmente. [13] El reactivo de Fétizon también se puede utilizar para facilitar la cicloadición de una 4-hidroxi-2-furoquinilona y una olefina para formar dihidrofuroquinolinonas. [14]
El para-metoxibencilo (PMB) es un grupo protector comúnmente utilizado para alcoholes contra el reactivo de Fétizon. [15] Como la oxidación de Fétizon es una reacción neutra, los grupos protectores sensibles a ácidos y bases también son compatibles con el reactivo y los subproductos generados.
Aunque los alcoholes terciarios normalmente no se ven afectados por el reactivo de Fétizon, se ha demostrado que los alcoholes propargílicos terciarios se oxidan en estas condiciones y dan como resultado la fragmentación del alcohol con un grupo saliente alquino . [16]

Se ha demostrado que las halohidrinas que poseen una estereoquímica trans forman epóxidos y productos transpuestos en presencia del reactivo de Fétizon. Las halohidrinas que poseen una estereoquímica cis parecen realizar una oxidación típica de Fétizon a una cetona. [17]

Los [1,3] dioles tienen una tendencia a eliminar agua después de la monooxidación por el reactivo de Fétizon para formar una enona . [8]

En diferentes condiciones estructurales, los dioles [1,2] pueden formar dicetonas en presencia del reactivo de Fétizon. Sin embargo, también puede producirse una ruptura oxidativa del enlace carbono-carbono. [18] [19]
Desde su descubrimiento como un método útil de oxidación, el reactivo de Fétizon se ha utilizado en la síntesis total de numerosas moléculas como (±)-bukittinggina. [20] El reactivo de Fétizon también se ha empleado ampliamente en el estudio de la química de varios azúcares, para lograr la oxidación selectiva de aldosas tri y tetrametiladas a aldolactonas, [21] la oxidación de D-xilosa y L-arabinosa a D-treosa y L-eritrosa respectivamente, [22] y la oxidación de L-sorbosa para producir L-treosa entre muchos otros. [23]
{{cite journal}}: Falta o está vacío |title=( ayuda ){{cite journal}}: Falta o está vacío |title=( ayuda )