Las proteínas morfogenéticas óseas ( BMP ) son un grupo de factores de crecimiento también conocidos como citocinas y metabológenos . [1] El profesor Marshall Urist y el profesor Hari Reddi descubrieron su capacidad para inducir la formación de hueso y cartílago ; ahora se considera que las BMP constituyen un grupo de señales morfogenéticas fundamentales que orquestan la arquitectura tisular en todo el cuerpo. [2] [3] El importante funcionamiento de las señales de BMP en la fisiología se enfatiza por la multitud de funciones de la señalización de BMP desregulada en procesos patológicos. La enfermedad cancerosa a menudo implica una mala regulación del sistema de señalización de BMP. La ausencia de señalización de BMP es, por ejemplo, un factor importante en la progresión del cáncer de colon, [4] y, a la inversa, la sobreactivación de la señalización de BMP después de una esofagitis inducida por reflujo provoca esófago de Barrett y, por lo tanto, es fundamental en el desarrollo del adenocarcinoma de esófago . [5]
Las BMP humanas recombinantes (rhBMP) se utilizan en aplicaciones ortopédicas como fusiones espinales , pseudoartrosis y cirugía oral. La rhBMP-2 y la rhBMP-7 están aprobadas por la Administración de Alimentos y Medicamentos (FDA) para algunos usos. La rhBMP-2 causa un crecimiento óseo mayor que cualquier otra BMP y se usa ampliamente fuera de indicación .
Las BMP para uso clínico se producen mediante tecnología de ADN recombinante (BMP humanas recombinantes; rhBMP). Las BMP-2 y BMP-7 recombinantes están actualmente aprobadas para uso humano. [6]
Las rhBMP se utilizan en cirugías orales. [7] [8] [9] Recientemente, también se ha encontrado que la BMP-7 se utiliza en el tratamiento de la enfermedad renal crónica (ERC). Se ha demostrado en modelos animales murinos que la BMP-7 revierte la pérdida de glomérulos debido a la esclerosis .
Un estudio de 2022 realizado por investigadores de la Clínica Mayo , la Universidad de Maastricht y Ethris GmBH, una empresa de biotecnología que se centra en la terapia con ARN, descubrió que el ARNm modificado químicamente que codifica BMP-2 promovía la curación dependiente de la dosis de las osteotomías femorales en ratas macho. Las moléculas de ARNm se combinaron dentro de partículas lipídicas no virales , se cargaron en esponjas y se implantaron quirúrgicamente en los defectos óseos. Permanecieron localizadas alrededor del sitio de aplicación. En comparación con la recepción directa de rhBMP-2, los tejidos óseos regenerados después del tratamiento con ARNm mostraron una resistencia superior y una menor formación de callos masivos. [10]
Aunque rhBMP-2 y rhBMP-7 se utilizan en el tratamiento de una variedad de afecciones relacionadas con los huesos, incluidas las fusiones espinales y las pseudoartrosis , no se comprenden los riesgos de este tratamiento no aprobado. [11] Si bien las rhBMP están aprobadas para aplicaciones específicas (fusiones espinales lumbares con un abordaje anterior y pseudoartrosis de tibia), hasta el 85 % de todo el uso de BMP es fuera de etiqueta . [11] rhBMP-2 se usa ampliamente en otras técnicas de fusión espinal lumbar (p. ej., utilizando un abordaje posterior, fusiones cervicales anteriores o posteriores [11] ).
En 2001, la Administración de Alimentos y Medicamentos (FDA) aprobó rhBMP-7 (también conocido como OP-1 ; Stryker Biotech ) para una exención de dispositivo humanitario como alternativa al autoinjerto en pseudoartrosis de huesos largos. [11] En 2004, la exención de dispositivo humanitario se extendió como una alternativa al autoinjerto para la fusión posterolateral. [11] En 2002, rhBMP-2 (Infuse; Medtronic ) fue aprobado para fusiones intercorporales lumbares anteriores (ALIF) con un dispositivo de fusión lumbar. [11] En 2008 fue aprobado para reparar pseudoartrosis lumbar posterolateral , fracturas abiertas de la diáfisis de la tibia con fijación de clavos intramedulares . [11] En estos productos, las BMP se administran al sitio de la fractura al ser incorporadas a un implante óseo y se liberan gradualmente para permitir la formación de hueso, ya que la estimulación del crecimiento por BMP debe ser localizada y sostenida durante algunas semanas. Las BMP se liberan a través de una matriz de colágeno purificada que se implanta en el lugar de la fractura. [6] La rhBMP-2 ayuda a que el hueso crezca mejor que cualquier otra rhBMP, por lo que se utiliza mucho más ampliamente en la práctica clínica. [6] Hay "poco debate o controversia" sobre la eficacia de la rhBMP-2 para hacer crecer el hueso y lograr fusiones espinales, [6] y Medtronic genera 700 millones de dólares en ventas anuales con su producto. [12]
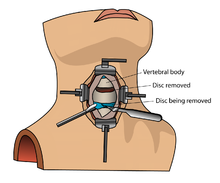
La proteína morfogenética ósea (rhBMP) no debe utilizarse rutinariamente en ningún tipo de fusión de la columna cervical anterior, como en la discectomía y fusión cervical anterior . [13] Hay informes de que esta terapia causa hinchazón del tejido blando , lo que a su vez puede causar complicaciones potencialmente mortales debido a la dificultad para tragar y la presión en el tracto respiratorio . [13]
Las BMP interactúan con receptores específicos en la superficie celular, denominados receptores de proteína morfogenética ósea (BMPR).
La transducción de señales a través de BMPR da como resultado la movilización de miembros de la familia de proteínas SMAD . Las vías de señalización que involucran BMP, BMPR y SMAD son importantes en el desarrollo del corazón, el sistema nervioso central y el cartílago, así como en el desarrollo óseo posnatal.
Tienen un papel importante durante el desarrollo embrionario en la formación del patrón embrionario y la formación esquelética temprana. Como tal, la interrupción de la señalización de BMP puede afectar el plan corporal del embrión en desarrollo. Por ejemplo, BMP4 y sus inhibidores noggin y chordin ayudan a regular la polaridad del embrión (es decir, el patrón de atrás hacia adelante). Específicamente, BMP-4 y sus inhibidores juegan un papel importante en la neurulación y el desarrollo de la placa neural . BMP-4 envía señales a las células del ectodermo para que se conviertan en células de la piel, pero la secreción de inhibidores por el mesodermo subyacente bloquea la acción de BMP-4 para permitir que el ectodermo continúe con su curso normal de desarrollo de células neurales. Además, la secreción de BMP por la placa del techo en la médula espinal en desarrollo ayuda a especificar las interneuronas sensoriales dorsales. [14]
Como miembro de la superfamilia del factor de crecimiento transformante beta, la señalización de BMP regula una variedad de patrones embrionarios durante el desarrollo fetal y embrionario. Por ejemplo, la señalización de BMP controla la formación temprana del conducto de Müller (MD), que es una estructura tubular en la etapa temprana del desarrollo embrionario y eventualmente se convierte en tractos reproductivos femeninos. La inhibición química de las señales de BMP en el embrión de pollo causó una interrupción de la invaginación del MD y bloqueó el engrosamiento epitelial de la región formadora de MD, lo que indica que las señales de BMP juegan un papel en el desarrollo temprano del MD. [15] Además, la señalización de BMP está involucrada en la formación del intestino anterior y posterior, [16] el patrón de las vellosidades intestinales y la diferenciación endocárdica. Las vellosidades contribuyen a aumentar la absorción efectiva de nutrientes al extender el área de superficie en el intestino delgado. La ganancia o pérdida de la función de la señalización de BMP alteró el patrón de los grupos y la aparición de vellosidades en el modelo intestinal de ratón. [17] La señal BMP derivada del miocardio también está involucrada en la diferenciación endocárdica durante el desarrollo del corazón. La señal BMP inhibida en el modelo embrionario de pez cebra causó una fuerte reducción de la diferenciación endocárdica, pero solo tuvo poco efecto en el desarrollo del miocardio . [18] Además, la comunicación cruzada Notch-Wnt-Bmp es necesaria para la formación de patrones radiales durante el desarrollo de la cóclea del ratón a través de un mecanismo antagónico. [19]
Las mutaciones en las BMP y sus inhibidores están asociadas con una serie de trastornos humanos que afectan el esqueleto.
Varias BMP también se denominan "proteínas morfogenéticas derivadas del cartílago" (CDMP), mientras que otras se conocen como " factores de diferenciación del crecimiento " (GDF). [20]
Las BMP también están involucradas en la adipogénesis y la regulación funcional del tejido adiposo. [21] BMP4 favorece la adipogénesis blanca, mientras que BMP7 activa la funcionalidad de la grasa parda; los inhibidores de BMP también están involucrados en esta regulación [21]
Originalmente, se descubrieron siete de estas proteínas. De ellas, seis (BMP2 a BMP7) pertenecen a la superfamilia de proteínas del factor de crecimiento transformante beta. BMP1 es una metaloproteasa . Desde entonces, se han descubierto trece BMP más, todas ellas de la familia TGF-beta, lo que eleva el total a veinte. [6] La nomenclatura actual solo reconoce 13, ya que muchas otras se incluyen bajo la denominación de factor de diferenciación del crecimiento.

Desde la época de Hipócrates se sabe que el hueso tiene un potencial considerable de regeneración y reparación. Nicholas Senn, cirujano del Rush Medical College de Chicago, describió la utilidad de los implantes óseos descalcificados y antisépticos en el tratamiento de la osteomielitis y ciertas deformidades óseas. [25] Pierre Lacroix propuso que podría existir una sustancia hipotética, la osteogenina, que podría iniciar el crecimiento óseo. [26]
Marshall R. Urist demostró la base biológica de la morfogénesis ósea . Urist hizo el descubrimiento clave de que los segmentos de hueso desmineralizados y liofilizados inducían la formación de hueso nuevo cuando se implantaban en bolsas musculares en conejos. Este descubrimiento fue publicado en 1965 por Urist en Science . [27] Urist propuso el nombre "Bone Morphogenetic Protein" en la literatura científica en el Journal of Dental Research en 1971. [28]
La inducción ósea es una cascada secuencial de varios pasos. Los pasos clave en esta cascada son la quimiotaxis , la mitosis y la diferenciación . Los primeros estudios de Hari Reddi desentrañaron la secuencia de eventos involucrados en la morfogénesis ósea inducida por la matriz ósea. [29] Sobre la base del trabajo anterior, parecía probable que los morfógenos estuvieran presentes en la matriz ósea. Utilizando una batería de bioensayos para la formación ósea, se realizó un estudio sistemático para aislar y purificar posibles proteínas morfogenéticas óseas.
Un obstáculo importante para la purificación fue la insolubilidad de la matriz ósea desmineralizada. Para superar este obstáculo, Hari Reddi y Kuber Sampath utilizaron extractantes disociativos, como 4M guanidina HCL , 8M urea o 1% SDS . [30] El extracto soluble solo o los residuos insolubles solos fueron incapaces de inducir hueso nuevo. Este trabajo sugirió que la actividad osteogénica óptima requiere una sinergia entre el extracto soluble y el sustrato de colágeno insoluble. No solo representó un avance significativo hacia la purificación final de las proteínas morfogenéticas óseas por parte del laboratorio de Reddi, [31] [32] sino que finalmente también permitió la clonación de BMP por parte de John Wozney y sus colegas en el Instituto de Genética. [33]
Con un costo de entre 6.000 y 10.000 dólares estadounidenses para un tratamiento típico, las BMP pueden ser costosas en comparación con otras técnicas como el injerto óseo . [ cita requerida ] Sin embargo, este costo es a menudo mucho menor que los costos requeridos con la revisión ortopédica en cirugías múltiples.
Aunque no hay mucho debate sobre el éxito clínico de las rhBMP, [6] existe controversia sobre su uso. Es habitual que se pague a los cirujanos ortopédicos por su contribución al desarrollo de un nuevo producto, [34] [35] pero algunos de los cirujanos responsables de los estudios originales financiados por Medtronic sobre la eficacia de la rhBMP-2 han sido acusados de parcialidad y conflicto de intereses. [36] Por ejemplo, un cirujano, autor principal de cuatro de estos artículos de investigación, no reveló ningún vínculo financiero mientras estuvo con la empresa en tres de los artículos; [37] Medtronic le pagó más de 4 millones de dólares. [37] En otro estudio, el autor principal no reveló ningún vínculo financiero con Medtronic; la empresa le pagó al menos 11 millones de dólares. [37] En una serie de 12 publicaciones, los vínculos financieros medios de los autores con Medtronic fueron de 12 a 16 millones de dólares. [38] En aquellos estudios que tenían más de 20 y 100 pacientes, uno o más autores tenían vínculos financieros de $1 millón y $10 millones, respectivamente. [38] Los primeros ensayos clínicos que utilizaron rhBMP-2 informaron menos eventos adversos asociados con el tratamiento. En las 13 publicaciones originales patrocinadas por la industria relacionadas con la seguridad, hubo cero eventos adversos en 780 pacientes. [38] Desde entonces se ha revelado que pueden surgir complicaciones potenciales del uso, incluido el desplazamiento del implante, hundimiento, infección , eventos urogenitales y eyaculación retrógrada . [37] [38]
Según un estudio realizado por el Departamento de Medicina Familiar de la Universidad de Ciencias y Salud de Oregón, el uso de BMP aumentó rápidamente, del 5,5% de los casos de fusión en 2003 al 28,1% de los casos de fusión en 2008. El uso de BMP fue mayor entre los pacientes con cirugía previa y entre aquellos que se sometieron a procedimientos de fusión complejos (abordaje anterior y posterior combinado, o más de 2 niveles de disco). Las complicaciones médicas importantes, las complicaciones de la herida y las tasas de rehospitalización a los 30 días fueron casi idénticas con o sin BMP. Las tasas de reoperación también fueron muy similares, incluso después de estratificar por cirugía previa o complejidad quirúrgica, y después de ajustar las características demográficas y clínicas. En promedio, los cargos hospitalarios ajustados para operaciones que involucraron BMP fueron aproximadamente $15.000 más que los cargos hospitalarios para fusiones sin BMP, aunque el reembolso según el sistema de Grupo Relacionado con el Diagnóstico de Medicare fue en promedio solo alrededor de $850 más. Significativamente menos pacientes que recibieron BMP fueron dados de alta a un centro de enfermería especializada. [39]