El hueso artificial se refiere a un material similar al hueso creado en un laboratorio que puede usarse en injertos óseos , para reemplazar el hueso humano que se perdió debido a fracturas graves, enfermedades, etc. [1]
La fractura ósea, que es una rotura total o parcial del hueso, es una afección muy común que tiene más de tres millones de casos en Estados Unidos por año. [2] Los huesos humanos tienen la capacidad de regenerarse a sí mismos mediante un ciclo de resorción y formación ósea. La célula responsable de la resorción ósea es el osteoclasto , mientras que la célula responsable de la formación ósea es el osteoblasto. Dicho esto, el cuerpo humano puede regenerar huesos fracturados. Sin embargo, si el daño al hueso es causado por una enfermedad o una lesión grave, al cuerpo le resulta difícil repararse a sí mismo. Cuando el cuerpo humano no puede regenerar el tejido óseo perdido, los cirujanos intervienen y reemplazan el hueso faltante mediante autoinjertos, aloinjertos e injertos sintéticos (hueso artificial). Al comparar el hueso artificial con el autoinjerto y el aloinjerto, es menos invasivo y más biocompatible ya que evita el riesgo de infecciones virales desconocidas. [3]
Al diseñar biomateriales implantados, los criterios clave son la biocompatibilidad , la osteoconductividad , la alta porosidad y la compatibilidad biomecánica. Inicialmente, el hueso artificial estaba hecho de materiales como metales y cerámica sólida, que son lo suficientemente fuertes como para soportar la carga en el hueso. Sin embargo, la rigidez de esos materiales creaba una carga enorme para los pacientes y no era coherente con los criterios para la implantación de biomateriales. Los huesos artificiales hechos de metal y cerámica tienden a tener malos resultados en términos de biocompatibilidad, ya que son difíciles de integrar en los tejidos óseos. [4] Por lo tanto, para ayudar mejor a quienes lo necesitan a vivir una vida más cómoda, los ingenieros han estado desarrollando nuevas técnicas para producir y diseñar mejores estructuras y materiales óseos artificiales.
Los dos componentes principales del hueso son la hidroxiapatita [Ca10(PO4)6(OH)2] y las fibras de colágeno. La hidroxiapatita, que es una de las formas más estables de fosfato cálcico, constituye entre el 60 y el 65 por ciento del hueso. [5] El resto del hueso está compuesto de materiales que incluyen sulfato de condroitina , sulfato de queratán y lípidos . [5] El aumento de la investigación y el conocimiento sobre la organización, estructura y propiedades del colágeno y la hidroxiapatita han llevado a muchos desarrollos en estructuras basadas en colágeno en la ingeniería del tejido óseo. La estructura de la hidroxiapatita es muy similar a la del hueso original y el colágeno puede actuar como cables moleculares y mejorar aún más la biocompatibilidad del implante. [6]
En los Estados Unidos, cada año se han notificado más de 6,5 millones de defectos óseos y más de 3 millones de casos de lesiones faciales. Cada año se realizan en todo el mundo más de 2,2 millones de procedimientos de injerto óseo. Las causas comunes del injerto óseo son la resección de tumores, malformaciones congénitas, traumatismos, fracturas, cirugía, osteoporosis y artritis. [7] Según la Encuesta Nacional de Atención Médica Ambulatoria (NAMCS), en 2010, hubo aproximadamente 63 millones de visitas al departamento de cirugía ortopédica y alrededor de 3,5 millones de visitas por fracturas en los departamentos de emergencia en los EE. UU. Entre los 6,5 millones de fracturas óseas o casos de defectos, aproximadamente 887.679 personas fueron hospitalizadas. [8]
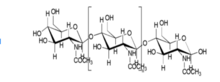
La investigación sobre tipos de materiales en injertos óseos se ha centrado tradicionalmente en la producción de compuestos de polisacáridos orgánicos ( quitina , quitosano , alginato ) y minerales ( hidroxiapatita ). Los andamios de alginato , compuestos de iones de calcio reticulados, se están explorando activamente en la regeneración de la piel, el hígado y los huesos. [9] La capacidad del alginato para estructurarse lo convierte en un polisacárido novedoso. Aunque muchos minerales pueden adaptarse para la composición ósea, la hidroxiapatita sigue siendo el material dominante, ya que su resistencia y el conocido modelo de hueso humano de Jager-Fratzl proporcionan un marco preexistente para el espaciamiento y la fabricación.

Los materiales adecuados para su uso en huesos artificiales deben ser biocompatibles, osteoconductores y mecánicamente fuertes. [5] La hidroxiapatita se utiliza a menudo en estudios de huesos artificiales porque tiene la biocompatibilidad y la osteoconductividad necesarias para un implante óseo efectivo y duradero, pero es bastante frágil, [5] y además exhibe una tasa de disolución de aproximadamente el 10 % en peso por año. , que es significativamente más lento que la tasa de crecimiento del hueso recién formado, lo que requiere medidas para mejorar su tasa de disolución. [10] Para aplicaciones que requieren un material con mejor tenacidad, se puede utilizar nácar artificial nanoestructurado debido a su alta resistencia a la tracción y módulo de Young . [11] En muchos casos, el uso de un tipo de material limita las capacidades de un implante óseo artificial, por lo que se utilizan compuestos. Los implantes compuestos de quitosano e hidroxiapatita aprovechan la biocompatibilidad del quitosano y su capacidad para moldearse en formas porosas complejas, así como la osteoconductividad de la hidroxiapatita, para crear un compuesto que presenta las tres características. [5] Otros compuestos adecuados para su uso en hueso artificial son los que utilizan alginato, un biopolímero conocido por sus propiedades de formación de andamios. Los usos del alginato en compuestos incluyen compuestos de quitosano para la reparación del tejido óseo, compuestos de biovidrio para reparar o reemplazar huesos defectuosos o enfermos, o compuestos de cerámica y colágeno para la regeneración ósea. [9] El material utilizado en un implante de hueso artificial depende en última instancia del tipo de implante que se crea y su uso.
La impresión 3D se está convirtiendo en una forma eficaz de producir huesos artificiales. En primer lugar, se crea un modelo óseo mediante la reconstrucción de imágenes de TAC obtenidas del paciente. Luego, los materiales óseos artificiales se utilizan como "filamentos" para la impresión 3D. Según la resolución de los injertos, el modelo óseo 3D se dividiría en algunas capas. La impresora imprimiría una capa, luego la siguiente sobre la última, y finalmente produciría un hueso artificial. La mayoría de los estudios recientes muestran que los nanocristales de hidroxiapatita (HA) son un material ideal para huesos artificiales impresos en 3D. Los nanocristales de HA se sintetizan mediante síntesis húmeda utilizando fosfato diamónico y cloruro de calcio como precursores de fósforo y calcio, respectivamente. [12] Además, la policaprolactona ( PCL) también se puede utilizar para la impresión 3D y producir hueso artificial en algunos informes de investigación. En comparación con la reparación de huesos dañados, la técnica de impresión 3D podría producir implantes que satisfagan las necesidades de reparación personalizadas. Por otro lado, las técnicas de impresión 3D producen implantes con pocos efectos adversos Las células huésped de diversas clasificaciones, como los linfocitos y los eritrocitos, muestran una respuesta inmunológica mínima a los injertos artificiales. [13]
Los materiales sustitutos óseos eficaces deben presentar una buena resistencia mecánica junto con una bioactividad adecuada. La bioactividad, que a menudo se mide en términos de velocidades de disolución y de formación de una capa mineral en la superficie del implante in vivo, puede mejorarse en los biomateriales, en particular la hidroxiapatita, modificando la composición y la estructura mediante dopaje. [10] Como alternativa a los sistemas de hidroxiaptatita, los compuestos de quitosano se han estudiado exhaustivamente como material para utilizar en huesos artificiales. [5] El quitosano por sí solo se puede modificar fácilmente en formas complejas que incluyen estructuras porosas, lo que lo hace adecuado para el crecimiento celular y la osteoconducción. [5] Además, los andamios de quitosano son biocompatibles y biodegradables, pero tienen baja tenacidad y el material en sí no es osteoconductor. [5] La hidroxiapatita, por otro lado, presenta una excelente biocompatibilidad, pero se ve obstaculizada por su naturaleza frágil. [14] Cuando se implementa con hidroxiapatita como compuesto, tanto la dureza como la osteoconductividad mejoran significativamente, lo que convierte al compuesto en una opción viable como material para hueso artificial. [5] El quitosano también se puede utilizar con nanotubos de carbono, que tienen un módulo de Young alto (1,0–1,8 TPa), resistencia a la tracción (30–200 GPa), alargamiento de rotura (10–30%) y relación de aspecto (>1000). ). [5] Los nanotubos de carbono son de tamaño muy pequeño, química y estructuralmente estables y bioactivos. [5] El compuesto formado por nanotubos de carbono y quitosano mejora enormemente la dureza del quitosano. [5] El nácar artificial nanoestructurado es otra opción para crear hueso artificial. [11] El nácar natural se compone de una disposición de capas orgánicas e inorgánicas similar al ladrillo y el mortero. [9] Esto, junto con la reticulación iónica de moléculas fuertemente plegadas, permite que el nácar tenga alta resistencia y dureza. [9] El nácar artificial que imitaba tanto la estructura como el efecto de los enlaces iónicos tenía una resistencia a la tracción similar al nácar natural, así como un módulo de Young final similar al del hueso laminar. [11] Desde un punto de vista mecánico, este material sería una opción viable para el hueso artificial.
Se deben considerar varios aspectos de cualquier diseño de hueso artificial antes de implementar el diseño en un paciente. Los implantes de hueso artificial que no encajan bien dentro de un paciente debido a eventos como dejar el hueso receptor sin fijar pueden causar enrojecimiento e hinchazón en la región receptora. [3] Los implantes mal ajustados también pueden deberse a la sinterización , que puede causar una contracción dimensional de un implante hasta en un 27%. [15] La osteoconductividad es otra consideración importante para el diseño de hueso artificial. Los materiales sinterizados aumentan la cristalinidad del fosfato cálcico en ciertos huesos artificiales, lo que conduce a una mala resorción por parte de los osteoclastos y a una biodegradabilidad comprometida . [15] Un estudio evitó esto mediante la creación de huesos artificiales hechos a medida, impresos con inyección de tinta, que utilizaban α-fosfato tricálcico (TCP), un material que se convierte en hidroxiapatita y solidifica el implante sin el uso de sinterización. [15] Además, el α-TCP es biocompatible y ayuda a formar hueso nuevo, lo que es mejor para los pacientes a largo plazo. [3] Los diseños de hueso artificial deben ser biocompatibles, tener osteoconductividad y durar largos períodos de tiempo dentro del paciente para ser una solución viable en comparación con los implantes óseos autólogos y alogénicos.
Los injertos artificiales mantienen una resistencia a la compresión comparable, pero en ocasiones carecen de similitud con el hueso humano en respuesta a fuerzas laterales o de fricción. [16] En particular, la topografía del hueso artificial es inexacta en comparación con su contraparte natural. En Grant et al., los injertos óseos artificiales producidos por deposición fusionada tenían en promedio un coeficiente de fricción un 20% menor en comparación con el hueso real. [16] Si bien las tomografías computarizadas y los modelos óseos posteriores son altamente indicativos de hueso real para la composición interna, el producto final depende de la resolución de la impresora. En los casos en que se producen defectos en la impresora, el problema más probable es una disminución de la resistencia a la compresión debido a huecos involuntarios. [15] Después de la implantación, la disminución de la proliferación y diferenciación celular es evidente a medida que los pacientes aumentan con la edad. Esto prolonga la integración de los injertos y dificulta la formación de tejido óseo. En modelos animales, la incorporación de aloinjertos provoca la formación de teratoma . Queda por ver si la probabilidad de que se produzca este evento aumenta significativamente o no. [2] Por lo tanto, es necesario un refuerzo con otros agentes biológicos para imitar la estructura del cuerpo. El colágeno tipo I , que constituye una parte importante de la masa orgánica del hueso, es un agente de andamiaje utilizado con frecuencia. Alternativamente, el polímero quitosano posee una respuesta biológica similar, concretamente la promoción de la osteogénesis in vivo. [2]
Las técnicas de fabricación más modernas incluyen la impresión por inyección de tinta. [17] En un estudio, una impresora de inyección de tinta 3D produjo implantes de autoinjerto para la mandíbula inferior de 10 pacientes. El implante de hidroxiapatita se produjo a partir de polvo de fosfato tricálcico que se endureció después de la hidratación. [17] El procedimiento quirúrgico se realizó tanto por motivos estéticos como funcionales. Todos los pacientes indicaron satisfacción con el producto óseo. En otro estudio, que examinó réplicas de fémures de cabra, se produjeron nanocristales de hidroxiapatita y se mezclaron in situ antes de cargar una impresora 3D. El estudio observó una ligera disminución en la resistencia a la compresión de los fémures, lo que podría atribuirse a una impresión imperfecta y a una mayor proporción de hueso esponjoso . En general, las técnicas de impresión 3D producen implantes con pocos efectos adversos en los pacientes. Las células huésped de diversas clasificaciones, como linfocitos y eritrocitos , mostraron una respuesta inmunológica mínima a los injertos artificiales. [2] Sólo en el caso de una esterilización inadecuada o una predisposición previa a la infección ocurrieron complicaciones significativas. La velocidad de impresión es el principal paso limitante en la producción de hueso artificial. Dependiendo del tipo de implante óseo, el tiempo de impresión puede variar desde una hora hasta varias. [15] A medida que las impresoras producen injertos de mayor resolución, la duración de la impresión aumenta proporcionalmente.
La investigación sobre materiales óseos artificiales ha revelado que los vidrios de silicato bioactivos y reabsorbibles ( biovidrio ), las vitrocerámicas y los fosfatos de calcio exhiben propiedades mecánicas similares a las del hueso humano. [18] Propiedades mecánicas similares no garantizan la biocompatibilidad. La respuesta biológica del cuerpo a esos materiales depende de muchos parámetros, incluida la composición química, la topografía, la porosidad y el tamaño de grano. [18] Si el material es metal, existe riesgo de corrosión e infección. Si el material es cerámico, es difícil darle la forma deseada y el hueso no puede reabsorberlo ni reemplazarlo debido a su alta cristalinidad. [3] La hidroxiapatita, por otro lado, ha demostrado excelentes propiedades para apoyar la adhesión, diferenciación y proliferación de células de osteogénesis, ya que es termodinámicamente estable y bioactiva. [18] Los huesos artificiales que utilizan hidroxiapatita combinados con tejido de colágeno ayudan a formar nuevos huesos en los poros y tienen una fuerte afinidad con los tejidos biológicos mientras mantienen la uniformidad con el tejido óseo adyacente. [3] A pesar de su excelente desempeño en la interacción con el tejido óseo, la hidroxiapatita tiene el mismo problema que la cerámica en la reabsorción debido a su alta cristalinidad. Dado que la hidroxiapatita se procesa a alta temperatura, es poco probable que permanezca en un estado estable. [3]