
El término hierro de alta valencia se refiere comúnmente a compuestos e intermediarios en los que el hierro se encuentra en un estado de oxidación formal > 3 que muestra un número de enlaces > 6 con un número de coordinación ≤ 6. El término es bastante poco común para compuestos de hierro hepta-coordinados. [1] Debe distinguirse de los términos hipervalente e hipercoordinado , ya que los compuestos de hierro de alta valencia no necesariamente violan la regla de los 18 electrones ni necesariamente muestran números de coordinación > 6. El ion ferrato(VI) [FeO 4 ] 2− fue la primera estructura de esta clase sintetizada. Los compuestos sintéticos discutidos a continuación contienen hierro altamente oxidado en general, ya que los conceptos están estrechamente relacionados.
Las especies de oxoferrilo se proponen comúnmente como intermediarios en ciclos catalíticos , especialmente sistemas biológicos en los que se requiere la activación del O 2 . El oxígeno diatómico tiene un alto potencial de reducción (E 0 = 1,23 V), pero el primer paso necesario para aprovechar este potencial es una reducción de un electrón termodinámicamente desfavorable E 0 = -0,16 V. Esta reducción ocurre en la naturaleza mediante la formación de un complejo superóxido en el que un metal reducido es oxidado por O 2 . El producto de esta reacción es un radical peróxido que es más fácilmente reactivo. Un método ampliamente aplicable para la generación de especies de oxoferrilo de alta valencia es la oxidación con yodosobenceno : [2]

Se han descrito varias síntesis de especies de oxohierro(IV). Las más simples son óxidos de metales mixtos de la forma MFeO 3 , con M=Ba, Ca o Sr. Sin embargo, estos compuestos no tienen aniones de hierro discretos. [3]
Se conocen especies aisladas de oxohierro(IV) con ligandos más complejos. Estos compuestos modelan complejos biológicos como el citocromo P450 , la NO sintasa y la isopenicilina N sintasa. Dos de estos compuestos descritos son el oxohierro(IV) ligado con tiolato y el oxohierro(IV) ciclamo-acetato. [4]
El oxohierro(IV) ligado con tiolato se forma por oxidación de un precursor, [Fe II (TMCS)](PF 6 ) (TMCS = 1-mercaptoetil-4,8,11-trimetil-1,4,8,11-tetrazaciclotetradecano), y 3-5 equivalentes de H 2 O 2 a -60 ˚C en metanol . El compuesto de hierro(IV) es de color azul oscuro y muestra características de absorción intensas a 460 nm, 570 nm, 850 nm y 1050 nm. Esta especie Fe IV (=O)(TMCS)+ es estable a -60 ˚C, pero se ha informado de descomposición a medida que aumenta la temperatura. El compuesto 2 se identificó mediante espectroscopia Mössbauer , espectrometría de masas de ionización por electrospray de alta resolución (ESI-MS), espectroscopia de absorción de rayos X , estructura fina de absorción de rayos X extendida (EXAFS), espectroscopia ultravioleta-visible (UV-vis), espectroscopia infrarroja por transformada de Fourier (FT-IR), y los resultados se compararon con cálculos de la teoría funcional de la densidad (DFT). [5]
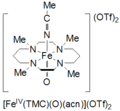
El tetrametilciclam oxohierro(IV) se forma por la reacción de Fe II (TMC)(OTf) 2 , TMC = 1,4,8,11-tetrametil-1,4,8,11-tetraazaciclotetradecano; OTf = CF3SO3 , con yodosilbenceno (PhIO) en CH3CN a -40 ˚C. Se informa de un segundo método para la formación de ciclamo oxohierro(IV) como la reacción de Fe II ( TMC )(OTf) 2 con 3 equivalentes de H2O2 durante 3 horas. Esta especie es de color verde pálido y tiene un máximo de absorción a 820 nm. Se informa que es estable durante al menos 1 mes a -40 ˚C. Se ha caracterizado por espectroscopia Mössbauer, ESI-MS, EXAFS, UV-vis, espectroscopia Raman y FT-IR. [6]
Los complejos de bispidina de hierro de alta valencia pueden oxidar ciclohexano a ciclohexanol y ciclohexanona con un rendimiento del 35 % con una relación alcohol-cetona de hasta 4. [7]
Fe V TAML(=O), TAML = ligando macrocíclico tetra-amido , se forma por la reacción de [Fe III (TAML)(H 2 O)](PPh 4 ) con 2-5 equivalentes de ácido meta-cloroperbenzoico a -60 ˚C en n-butironitrilo. Este compuesto de color verde oscuro (dos λ máx. a 445 y 630 nm respectivamente) es estable a 77 K. La estabilización de Fe(V) se atribuye a la fuerte capacidad de donante π de los nitrógenos de amida desprotonados. [8]
El ferrato(VI) es un anión inorgánico de fórmula química [FeO 4 ] 2− . Es fotosensible y aporta un color violeta pálido a sus compuestos y soluciones. Es una de las especies oxidantes más fuertes y estables en agua que se conocen. Aunque se clasifica como una base débil , las soluciones concentradas de ferrato(VI) solo son estables a pH alto .
Se ha revisado la estructura electrónica de los compuestos de oxohierro de porfirina. [9]

Los compuestos de nitridohierro [10] e imidohierro [11] están estrechamente relacionados con la química de hierro-dinitrógeno . [12] Se ha revisado la importancia biológica de las porfirinas de nitridohierro (V). [13] [14] Un método ampliamente aplicable para generar especies de nitridohierro de alta valencia es la eliminación oxidativa térmica o fotoquímica del nitrógeno molecular de un complejo de azida .
Existen varios compuestos de nitridohierro(IV) caracterizados estructuralmente. [15] [16] [17]
El primer compuesto de nitridohierro(V) fue sintetizado y caracterizado por Wagner y Nakamoto (1988, 1989) utilizando fotólisis y espectroscopia Raman a bajas temperaturas. [18] [19]
Se ha descrito una segunda especie de Fe VI aparte del ion ferrato(VI) , [(Me 3 cy-ac)FeN](PF 6 ) 2 . Esta especie se forma por oxidación seguida de fotólisis para producir la especie Fe(VI). La caracterización del complejo Fe(VI) se realizó mediante cálculos de Mossbauer, EXAFS, IR y DFT. A diferencia del ion ferrato(VI), el compuesto 5 es diamagnético . [20]
Los compuestos de ftalocianina de hierro μ-nitrido puenteados, como la ftalocianina de hierro (II), catalizan la oxidación de metano a metanol , formaldehído y ácido fórmico utilizando peróxido de hidrógeno como oxidante de sacrificio. [21] [22]
Las especies de nitridohierro(IV) y nitridohierro(V) se exploraron teóricamente por primera vez en 2002. [23]