La evolución de los iones metálicos en los sistemas biológicos se refiere a la incorporación de iones metálicos en los organismos vivos y cómo ha cambiado con el tiempo. Los iones metálicos han estado asociados con los sistemas biológicos durante miles de millones de años, pero sólo en el último siglo los científicos comenzaron a apreciar verdaderamente la magnitud de su influencia. Los iones metálicos mayores ( hierro , manganeso , magnesio y zinc ) y menores ( cobre , cobalto , níquel , molibdeno , tungsteno ) se han alineado con los organismos vivos a través de la interacción de la erosión biogeoquímica y las vías metabólicas que involucran los productos de esa erosión. Los complejos asociados han evolucionado con el tiempo.
El desarrollo natural de sustancias químicas y elementos desafió a los organismos a adaptarse o morir. Los organismos actuales requieren reacciones redox para inducir el metabolismo y otros procesos vitales. Los metales tienen tendencia a perder electrones y son importantes para las reacciones redox.
Los metales se han vuelto tan centrales para la función celular que el conjunto de proteínas de unión a metales (conocidas como metalomas ) representa más del 30% de todas las proteínas de la célula. Se sabe que los metales participan en más del 40% de las reacciones enzimáticas y las proteínas que se unen a metales llevan a cabo al menos un paso en casi todas las vías biológicas . [1]
Los metales también son tóxicos, por lo que se debe adquirir un equilibrio para regular dónde se encuentran los metales en un organismo y en qué cantidades. Muchos organismos tienen sistemas flexibles en los que pueden intercambiar un metal por otro si alguno escasea. Los metales en esta discusión son elementos naturales que tienen tendencia a sufrir oxidación . El vanadio, el molibdeno, el cobalto, el cobre, el cromo, el hierro, el manganeso, el níquel y el zinc se consideran esenciales porque sin ellos la función biológica se ve afectada.
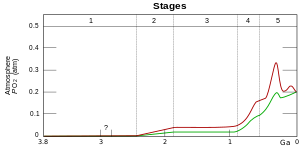
La Tierra comenzó como un mundo acuático de hierro con poco oxígeno. El Gran Evento de Oxigenación ocurrió aproximadamente hace 2,4 Ga (hace mil millones de años) cuando las cianobacterias y la vida fotosintética indujeron la presencia de dioxígeno en la atmósfera del planeta. El hierro se volvió insoluble (al igual que otros metales) y escaso, mientras que otros metales se volvieron solubles. El azufre fue un elemento muy importante durante esta época. Una vez que se liberó oxígeno al medio ambiente, los sulfatos hicieron que los metales fueran más solubles y los liberaron al medio ambiente; especialmente en el agua. [1] La incorporación de metales quizás combatió el estrés oxidativo.
La química central de todas estas células tiene que ser reductiva para que sea posible la síntesis de las sustancias químicas necesarias, especialmente biopolímeros . Las diferentes vías metabólicas anaeróbicas , autocatalizadas y reductoras observadas en las primeras células conocidas se desarrollaron en vesículas energizadas separadas, las protocélulas , donde se produjeron en cooperación con ciertas bases de los ácidos nucleicos. [2]
Las hipótesis propuestas sobre cómo los elementos se volvieron esenciales es su cantidad relativa en el medio ambiente a medida que se formó la vida. Esto ha producido investigaciones sobre el origen de la vida; por ejemplo, Orgel y Crick plantearon la hipótesis de que la vida era extraterrestre debido a la supuesta baja abundancia de molibdeno en la Tierra primitiva (ahora se sospecha que había cantidades mayores de lo que se pensaba anteriormente [ cita necesaria ] ). Otro ejemplo es la formación de vida alrededor de respiraderos térmicos basada en la disponibilidad de zinc y azufre. [1] En conjunto con esta teoría está que la vida evolucionó como quimioautótrofos . Por tanto, la vida se produjo alrededor de los metales y no en respuesta a su presencia. Alguna evidencia de esta teoría es que la materia inorgánica tiene atributos autónomos que la vida adoptó, como lo demuestra la compartimentación de la vida. [2] Otra evidencia incluye la fácil unión de metales mediante proteínas artificiales sin historia evolutiva. [3]
La química prebiótica de la vida tenía que ser reductiva para poder obtener, por ejemplo, monóxido de carbono (CO) y cianuro de hidrógeno (HCN) a partir del CO 2 y N 2 existentes en la atmósfera. El CO y el HCN fueron moléculas precursoras de las biomoléculas esenciales , proteínas , lípidos , nucleótidos y azúcares . [4] Sin embargo, los niveles de oxígeno atmosférico aumentaron considerablemente, y entonces fue necesario que las células tuvieran control sobre la reducción y oxidación de moléculas tan pequeñas para poder construir y descomponer células cuando fuera necesario, sin la inevitable oxidación (descomposición) de todo. Los iones de metales de transición , debido a sus múltiples estados de oxidación, eran los únicos elementos capaces de controlar los estados de oxidación de tales moléculas y, por lo tanto, fueron seleccionados. [5]
Donantes de O [ definición necesaria ] como HPO2-4
eran abundantes en la atmósfera prebiótica. [6] La unión de iones metálicos a dichos donantes de O era necesaria para construir los polímeros biológicos, ya que el enlace es generalmente débil, puede catalizar la reacción requerida y disociarse después (es decir, Mg 2+ en la síntesis de ADN ).
Alrededor de 4 Ga , el agua de mar ácida contenía altas cantidades de H 2 S y, por lo tanto, creó un ambiente reductor con un potencial de alrededor de −0,2 V. [6] Entonces, cualquier elemento que tuviera un gran valor negativo con respecto al potencial de reducción del ambiente estaba disponible en su forma iónica libre y posteriormente puede incorporarse a las células, es decir, el Mg 2+ tiene un potencial de reducción de −2,372 V y en aquel momento estaba disponible en su forma iónica.
Hacia el año 2 Ga se produjo un aumento de los niveles de oxígeno atmosférico , provocando una oxidación del H 2 S en el entorno y un aumento del pH del agua del mar. El ambiente resultante se había vuelto más oxidante y permitió así la incorporación posterior de metales más pesados como el cobre y el zinc . [7]
Otro factor que afectó a la disponibilidad de iones metálicos fue su solubilidad en H2S . El sulfuro de hidrógeno era abundante en el mar primitivo dando lugar a H 2 S en las condiciones ácidas prebióticas y HS - en las condiciones neutras ( pH = 7,0). En la serie de los sulfuros metálicos, la insolubilidad aumenta a pH neutro siguiendo la serie de Irving-Williams :
Así , en grandes cantidades de H2S , que era la condición prebiótica , sólo el Fe estaba disponible de manera más prominente en su forma iónica debido a su baja insolubilidad con los sulfuros . La creciente oxidación de H 2 S en SO2-4
conduce a la liberación posterior de Co +2 , Ni +2 , Cu +2 y Zn +2 ya que todos sus sulfatos son solubles.
El magnesio es el octavo elemento más abundante en la tierra. Es el cuarto elemento más abundante en los vertebrados y el catión divalente más abundante dentro de las células. La forma más disponible de magnesio (Mg 2+ ) para los organismos vivos se puede encontrar en la hidrosfera. La concentración de Mg 2+ en el agua de mar es de alrededor de 55 mM. El Mg 2+ está fácilmente disponible para las células durante la evolución temprana debido a su alta solubilidad en agua. Otros metales de transición, como el calcio, precipitan en soluciones acuosas en concentraciones mucho más bajas que las correspondientes sales de Mg 2+ . [8]
Dado que el magnesio estaba disponible en las primeras etapas de la evolución, se puede encontrar en todos los tipos de células de organismos vivos. El magnesio en los procariotas anaeróbicos se puede encontrar en MgATP . El magnesio también tiene muchas funciones en procariotas como la glucólisis , todas las quinasas, reacción NTP, señalización, estructuras de ADN/ARN y captura de luz. En los eucariotas aeróbicos, el magnesio se puede encontrar en el citoplasma y los cloroplastos . Las reacciones en estos compartimentos celulares son la glucólisis, la fotofosforilación y la asimilación de carbono .
El ATP, la principal fuente de energía en casi todos los organismos vivos, debe unirse con iones metálicos como Mg 2+ o Ca 2+ para funcionar. El examen de células con un suministro limitado de magnesio ha demostrado que la falta de magnesio puede provocar una disminución del ATP. [9] El magnesio en la hidrólisis del ATP actúa como cofactor para estabilizar el estado de transición de alta carga negativa . [10] El MgATP se puede encontrar tanto en células procariotas como eucariotas. Sin embargo, la mayor parte del ATP de las células es MgATP. Siguiendo la serie de Irving-Williams , el magnesio tiene una constante de unión más alta que el Ca 2+ . Por tanto, el ATP dominante en los organismos vivos es el MgATP. Una mayor constante de unión también le da al magnesio la ventaja de ser un mejor catalizador sobre otros metales de transición competidores.
La evidencia sugiere que el manganeso (Mn) se incorporó por primera vez a los sistemas biológicos hace aproximadamente 3.200 a 2.800 millones de años, durante el Período Arcaico . Junto con el calcio, formó el complejo de óxido de calcio y manganeso (determinado por difracción de rayos X ), que consistía en un grupo de manganeso, esencialmente una estructura inorgánica cubana (cúbica). La incorporación de un centro de manganeso en el fotosistema II fue muy significativa, ya que permitió la evolución fotosintética de oxígeno de las plantas. El complejo liberador de oxígeno (OEC) es un componente crítico del fotosistema II contenido en las membranas tilacoides de los cloroplastos; es responsable de la fotooxidación terminal del agua durante reacciones luminosas . [11]
La incorporación de Mn en proteínas permitió a los complejos la capacidad de reducir especies reactivas de oxígeno en Mn- superóxido dismutasa (MnSOD) y catalasa , en catálisis dependiente de transferencia de electrones (por ejemplo, en ciertas ribonucleótidos reductasas de clase I ) y en la oxidación de agua por fotosistema II (PSII), donde disminuye la producción de sustancias reactivas al ácido tiobarbitúrico. Esto se debe a la capacidad del manganeso para reducir el anión superóxido y los radicales hidroxilo , así como a su capacidad de romper cadenas. [12]
El hierro (Fe) es el elemento más abundante en la Tierra y el cuarto elemento más abundante en la corteza, aproximadamente el 5 por ciento en masa. Debido a la abundancia de hierro y su papel en los sistemas biológicos , las etapas de transición y mineralógicas del hierro han jugado un papel clave en los sistemas de la superficie terrestre. Desempeñó un papel más importante en el pasado geológico en la geoquímica marina , como lo demuestran los depósitos de sedimentos precámbricos ricos en hierro. La transformación redox de Fe (II) a Fe (III), o viceversa, es vital para una serie de procesos biológicos y de ciclos de elementos. Se considera que la reducción de Fe(III) oxida el azufre (de H 2 S a SO 4 −2 ), que es un proceso central en los sedimentos marinos. Muchas de las primeras metaloproteínas consistían en complejos de hierro y azufre formados durante la fotosíntesis . [13] El hierro es el principal metal redox en los sistemas biológicos. En las proteínas , se encuentra en una variedad de sitios y cofactores, incluidos, por ejemplo, grupos hemo , sitios Fe-O-Fe y grupos hierro-azufre.
La prevalencia del hierro se debe aparentemente a la gran disponibilidad de Fe(II) en la evolución inicial de los organismos vivos, antes del aumento de la fotosíntesis y del aumento de los niveles de oxígeno atmosférico que dio lugar a la precipitación del hierro en el medio ambiente como Fe(OH). ) 3 . Tiene propiedades redox flexibles porque dichas propiedades son sensibles a la coordinación del ligando , incluida la geometría. El hierro también se puede utilizar en enzimas debido a sus propiedades del ácido de Lewis , por ejemplo en la nitrilo hidratasa. El hierro se encuentra frecuentemente en sitios mononucleares en forma reducida de Fe (II) y funciona en la activación del dioxígeno; esta función es utilizada como un mecanismo importante adoptado por los organismos vivos para evitar la barrera cinética que impide la transformación de compuestos orgánicos por el O 2 . [14] El hierro se puede absorber selectivamente en forma de ferredoxinas, Fe-O-Fe (hemeritrina y ribonucleótido reductasa), Fe (muchas oxidasas), además de la porfirina de hierro. La variación de las proteínas relacionadas con cualquiera de estas formas químicas de hierro ha producido una amplia gama de enzimas. Todas estas disposiciones se modifican para funcionar tanto en el sentido de reactividad como en el posicionamiento de la proteína en la célula. El hierro puede tener varios estados redox y de espín, y puede mantenerse en muchas estereoquímicas. [15]
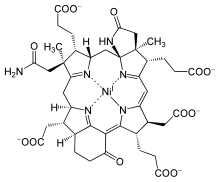

Alrededor del 4-3 Ga , los procariotas anaeróbicos comenzaron a desarrollar cofactores metálicos y orgánicos para la absorción de luz. Al final terminaron produciendo clorofila a partir de Mg(II), como se encuentra en las cianobacterias y las plantas, lo que condujo a la fotosíntesis moderna . Sin embargo, la síntesis de clorofila requiere numerosos pasos. El proceso comienza con la uroporfirina, un precursor primitivo del anillo de porfirina que puede ser de origen biótico o abiótico , que luego se modifica en las células de manera diferente para producir complejos de Mg , Fe , níquel (Ni) y cobalto (Co) . Los centros de estos anillos no son selectivos, lo que permite incorporar una variedad de iones metálicos. La porfirina de magnesio da lugar a clorofila, la porfirina de Fe a proteínas hemo , la porfirina de Ni produce el factor F-430 y la coenzima B12 de coporfirina . [dieciséis]
Antes del Gran Evento de Oxigenación , el cobre no estaba disponible para los organismos vivos. La mayor parte del cobre primitivo era Cu + y Cu. Este estado de oxidación del cobre es poco soluble en agua. Hace mil millones de años, después del gran evento de oxidación, la presión del oxígeno aumentó lo suficiente como para oxidar el Cu + a Cu 2+ , aumentando su solubilidad en agua. Como resultado, el cobre se volvió mucho más disponible para los organismos vivos.
La mayoría de las proteínas y enzimas que contienen cobre se pueden encontrar en eucariotas . Sólo un puñado de procariotas , como las bacterias aeróbicas y las cianobacterias, contienen enzimas o proteínas de cobre. El cobre se puede encontrar en la enzima superóxido dismutasa (SOD) tanto de procariotas como de eucariotas . Hay tres tipos distintos de SOD, que contienen Mn, Fe y Cu respectivamente. Mn-SOD y Fe-SOD se encuentran en la mayoría de los procariotas y mitocondrias de las células eucariotas. La Cu-SOD se puede encontrar en la fracción citoplasmática de las células eucariotas. Los tres elementos, cobre, hierro y manganeso, pueden catalizar el superóxido a oxígeno molecular ordinario o peróxido de hidrógeno. Sin embargo, Cu-SOD es más eficiente que Fe-SOD y Mn-SOD. La mayoría de los procariotas sólo utilizan Fe-SOD o Mn-SOD debido a la falta de cobre en el medio ambiente. Algunos organismos no desarrollaron Cu-SOD debido a la falta de un acervo genético para la adopción de Cu-SOD. [17]
El zinc (Zn) se incorporó a las células vivas en dos oleadas. Surgieron de cuatro a tres Ga , procariotas anaeróbicos, y la atmósfera estaba llena de H 2 S y era altamente reductiva. Por tanto, la mayor parte del zinc estaba en forma de ZnS insoluble . Sin embargo, debido a que el agua de mar en ese momento era ligeramente ácida, algo de Zn (II) estaba disponible en su forma iónica y pasó a formar parte de las proteasas externas , nucleasas externas, sintetasas internas y deshidrogenasas de los primeros procariotas anaeróbicos . [7]
Durante la segunda ola, una vez ocurrido el Gran Evento de Oxigenación, había más iones Zn(II) disponibles en el agua de mar. Esto permitió su incorporación en los eucariotas unicelulares tal como surgieron en este momento. Se cree que la posterior adición de iones como zinc y cobre les permitió desplazar al hierro y al manganeso de la enzima superóxido dismutasa (SOD). Los complejos de Fe y Mn se disocian fácilmente (serie de Irving-Williams), mientras que Zn y Cu no. Esta es la razón por la que la SOD eucariota contiene Cu o Zn y su contraparte procariótica contiene Fe o Mn. [7]
El Zn (II) no representa una amenaza de oxidación para el citoplasma . Esto le permitió convertirse en un elemento citoplasmático importante en los eucariotas. Se asoció con un nuevo grupo de proteínas de transcripción , los dedos de zinc . Esto sólo pudo haber ocurrido debido a la larga vida de los eucariotas, lo que dio tiempo al zinc para intercambiarse y, por lo tanto, convertirse en un mensajero interno que coordina la acción de otros factores de transcripción durante el crecimiento. [7]
El molibdeno (Mo) es el elemento de transición más abundante en solución en el mar (principalmente como ion molibdato dianiónico) y en los organismos vivos, su abundancia en la corteza terrestre es bastante baja. Por tanto, el uso de Mo por parte de organismos vivos parece sorprendente a primera vista. Las arqueas , las bacterias, los hongos, las plantas y los animales, incluidos los humanos, necesitan molibdeno. También se encuentra en más de 50 enzimas diferentes . Su hidrólisis a especies oxoaniónicas solubles en agua hace que el Mo sea fácilmente accesible. El Mo se encuentra en los sitios activos de las metaloenzimas que realizan transformaciones clave en el metabolismo de los compuestos de carbono, nitrógeno, arsénico, selenio, azufre y cloro. Las enzimas mononucleares Mo están ampliamente distribuidas en la biosfera; catalizan muchas reacciones importantes en el metabolismo de compuestos que contienen nitrógeno y azufre, así como de diversos compuestos carbonílicos (p. ej., aldehídos, CO y CO 2 ). Las enzimas nitrato reductasas son importantes para el ciclo del nitrógeno. Pertenecen a una clase de enzimas con un centro mononuclear de Mo y catalizan la reacción metabólica de C, N, S, etc., en bacterias, plantas, animales y humanos. [18] Debido a la oxidación de los sulfuros , el primer desarrollo considerable fue el de las bacterias aeróbicas que ahora podían utilizar Mo. [11] A medida que el oxígeno comenzó a acumularse en la atmósfera y los océanos, la reacción de MoS 2 a MoO 4 también aumentó. Esta reacción hizo que el ion molibdato altamente soluble estuviera disponible para su incorporación en metaloenzimas críticas y, por lo tanto, pudo haber permitido que la vida prosperara. Permitió a los organismos ocupar nuevos nichos ecológicos. Mo juega un papel importante en la reducción de dinitrógeno a amoníaco , lo que ocurre en un tipo de nitrogenasas . Estas enzimas son utilizadas por bacterias que suelen vivir en relación simbiótica con las plantas; su función es la fijación de nitrógeno , que es vital para sustentar la vida en la Tierra. Las enzimas Mo también desempeñan funciones importantes en el metabolismo del azufre de organismos que van desde bacterias hasta humanos. [18]

El tungsteno es uno de los iones metálicos más antiguos incorporados a los sistemas biológicos, precediendo al Gran Evento de Oxigenación. Antes de la abundancia de oxígeno en la atmósfera terrestre, los océanos estaban llenos de azufre y tungsteno, mientras que el molibdeno, un metal químicamente muy similar, era inaccesible en forma sólida. La abundancia de tungsteno y la falta de molibdeno libre probablemente explican por qué los primeros organismos marinos incorporaron el primero en lugar del segundo. Sin embargo, a medida que las cianobacterias comenzaron a llenar la atmósfera con oxígeno, el molibdeno estuvo disponible (el molibdeno se vuelve soluble cuando se expone al oxígeno) y el molibdeno comenzó a reemplazar al tungsteno en la mayoría de los procesos metabólicos , lo que se ve hoy en día, ya que el tungsteno solo está presente en el medio biológico. complejos de procariotas (metanógenos, bacterias grampositivas, aerobias y anaerobias gramnegativas), y sólo está obligado en arqueas hipertermófilas como P. furiosus . [19]
Aunque la investigación sobre los complejos enzimáticos específicos en los que se incorpora el tungsteno es relativamente reciente (década de 1970), las tungstoenzimas naturales se encuentran en abundancia en una gran cantidad de microorganismos procarióticos. Estos incluyen formiato deshidrogenasa, formil metanufurano deshidrogenasa, acetileno hidratasa y una clase de oxidorreductasas filogenéticamente relacionadas que catalizan la oxidación reversible de aldehídos. La primera estructura cristalina de una enzima que contiene tungsteno o pterina , la aldehído ferredoxina oxidorreductasa de P. furiosus, ha revelado un sitio catalítico con un átomo de W coordinado con dos moléculas de pterina que a su vez están unidas por un ion magnesio. [18]