El mendelevio es un elemento químico sintético ; su símbolo es Md (antes Mv) y su número atómico es 101. Es un elemento transuránico radiactivo metálico de la serie de los actínidos , el primer elemento por número atómico que actualmente no se puede producir en cantidades macroscópicas mediante el bombardeo de neutrones de elementos más ligeros . Es el antepenúltimo actínido y el noveno elemento transuránico y el primer transfermio. Solo se puede producir en aceleradores de partículas bombardeando elementos más ligeros con partículas cargadas. Se conocen diecisiete isótopos ; el más estable es el 258 Md con una vida media de 51,59 días; sin embargo, el 256 Md de vida más corta (vida media de 77,7 minutos ) es el más utilizado en química porque se puede producir a mayor escala.
El mendelevio se descubrió bombardeando einstenio con partículas alfa en 1955, el método que todavía se utiliza para producirlo en la actualidad. Recibe su nombre en honor a Dmitri Mendeleev , el padre de la tabla periódica . Utilizando cantidades disponibles de microgramos de einstenio-253, se pueden formar más de un millón de átomos de mendelevio cada hora. La química del mendelevio es típica de los actínidos tardíos, con una preponderancia del estado de oxidación +3 pero también un estado de oxidación +2 accesible. Todos los isótopos conocidos del mendelevio tienen vidas medias cortas; actualmente no hay usos para él fuera de la investigación científica básica , y solo se producen pequeñas cantidades.

El mendelevio fue el noveno elemento transuránico en ser sintetizado. Fue sintetizado por primera vez por Albert Ghiorso , Glenn T. Seaborg , Gregory Robert Choppin , Bernard G. Harvey y el líder del equipo Stanley G. Thompson a principios de 1955 en la Universidad de California, Berkeley. El equipo produjo 256 Md ( vida media de 77,7 minutos [4] ) cuando bombardearon un objetivo de 253 Es que consistía en solo mil millones (10 9 ) de átomos de einstenio con partículas alfa ( núcleos de helio ) en el ciclotrón de 60 pulgadas del Laboratorio de Radiación de Berkeley , aumentando así el número atómico del objetivo en dos. El 256 Md se convirtió así en el primer isótopo de cualquier elemento en ser sintetizado un átomo a la vez. En total, se produjeron diecisiete átomos de mendelevio. [5] Este descubrimiento fue parte de un programa, iniciado en 1952, que irradiaba plutonio con neutrones para transmutarlo en actínidos más pesados. [6] Este método era necesario ya que el método anterior utilizado para sintetizar elementos transuránicos, la captura de neutrones , no podía funcionar debido a la falta de isótopos de desintegración beta conocidos del fermio que producirían isótopos del siguiente elemento, el mendelevio, y también debido a la vida media muy corta hasta la fisión espontánea del 258 Fm que, por lo tanto, constituía un límite estricto para el éxito del proceso de captura de neutrones. [4]
Para predecir si sería posible la producción de mendelevio, el equipo hizo uso de un cálculo aproximado. El número de átomos que se producirían sería aproximadamente igual al producto del número de átomos del material objetivo, la sección transversal del objetivo, la intensidad del haz de iones y el tiempo de bombardeo; este último factor estaba relacionado con la vida media del producto cuando se bombardeaba durante un tiempo del orden de su vida media. Esto dio un átomo por experimento. Por lo tanto, en condiciones óptimas, se podía esperar la preparación de solo un átomo del elemento 101 por experimento. Este cálculo demostró que era factible seguir adelante con el experimento. [5] El material objetivo, einstenio-253, podría producirse fácilmente a partir de la irradiación de plutonio : un año de irradiación daría mil millones de átomos, y su vida media de tres semanas significaba que los experimentos con el elemento 101 podrían llevarse a cabo en una semana después de que el einstenio producido se separara y purificara para hacer el objetivo. Sin embargo, era necesario modernizar el ciclotrón para obtener la intensidad necesaria de 10 14 partículas alfa por segundo; Seaborg solicitó los fondos necesarios. [6]

Mientras Seaborg solicitaba financiación, Harvey trabajaba en el blanco de einstenio, mientras que Thomson y Choppin se centraron en los métodos de aislamiento químico. Choppin sugirió utilizar ácido α-hidroxiisobutírico para separar los átomos de mendelevio de los de los actínidos más ligeros. [6] La síntesis real se realizó mediante una técnica de retroceso, introducida por Albert Ghiorso. En esta técnica, el einstenio se colocó en el lado opuesto del objetivo al haz, de modo que los átomos de mendelevio que retrocedían adquirieran suficiente impulso para abandonar el objetivo y quedar atrapados en una lámina de oro. Este blanco de retroceso se fabricó mediante una técnica de galvanoplastia, desarrollada por Alfred Chetham-Strode. Esta técnica dio un rendimiento muy alto, lo que era absolutamente necesario cuando se trabajaba con un producto tan raro y valioso como el material del blanco de einstenio. [5] El blanco de retroceso consistía en 10 9 átomos de 253 Es que se depositaron electrolíticamente sobre una fina lámina de oro. Fue bombardeado por partículas alfa de 41 MeV en el ciclotrón Berkeley con una densidad de haz muy alta de 6×10 13 partículas por segundo sobre un área de 0,05 cm 2 . El objetivo fue enfriado con agua o helio líquido , y la lámina podía reemplazarse. [5] [7]
Los experimentos iniciales se llevaron a cabo en septiembre de 1954. No se observó desintegración alfa en los átomos de mendelevio; por lo tanto, Ghiorso sugirió que todo el mendelevio se había desintegrado por captura de electrones en fermio y que el experimento debería repetirse para buscar eventos de fisión espontánea . [6] La repetición del experimento ocurrió en febrero de 1955. [6]

El día del descubrimiento, el 19 de febrero, la irradiación alfa del blanco de einstenio se llevó a cabo en tres sesiones de tres horas. El ciclotrón estaba en el campus de la Universidad de California , mientras que el Laboratorio de Radiación estaba en la colina de al lado. Para hacer frente a esta situación, se utilizó un procedimiento complejo: Ghiorso llevó las láminas del receptor (había tres blancos y tres láminas) del ciclotrón a Harvey, quien usaría agua regia para disolverlas y las pasaría a través de una columna de resina de intercambio aniónico para separar los elementos transuránicos del oro y otros productos. [6] [8] Las gotas resultantes entraron en un tubo de ensayo , que Choppin y Ghiorso llevaron en un coche para llegar al Laboratorio de Radiación lo antes posible. Allí, Thompson y Choppin utilizaron una columna de resina de intercambio catiónico y el ácido α-hidroxiisobutírico. Las gotas de solución se recogieron en discos de platino y se secaron bajo lámparas de calor. Se esperaba que los tres discos contuvieran respectivamente el fermio, ningún elemento nuevo y el mendelevio. Finalmente, se colocaron en sus propios contadores, que estaban conectados a grabadoras de modo que los eventos de fisión espontánea se registrarían como enormes desviaciones en un gráfico que mostraba el número y el tiempo de las desintegraciones. Por lo tanto, no hubo detección directa, sino mediante la observación de eventos de fisión espontánea que surgían de su hija de captura de electrones, 256 Fm. El primero fue identificado con un "hurra" seguido de un "doble hurra" y un "triple hurra". El cuarto finalmente demostró oficialmente la identificación química del elemento 101, el mendelevio. En total, se informaron cinco desintegraciones hasta que a las 4 am se notificó a Seaborg y el equipo se fue a dormir. [6] Análisis adicionales y más experimentos mostraron que el isótopo mendelevio producido tenía una masa de 256 y se desintegraba por captura de electrones en fermio-256 con una vida media de 157,6 minutos. [4]
Nos pareció apropiado que hubiera un elemento que llevara el nombre del químico ruso Dmitri Mendeleev, que había desarrollado la tabla periódica. En casi todos nuestros experimentos para descubrir elementos transuránicos, habíamos dependido de su método de predicción de propiedades químicas en función de la posición del elemento en la tabla. Pero en medio de la Guerra Fría, ponerle a un elemento el nombre de un ruso fue un gesto un tanto atrevido que no sentó bien a algunos críticos estadounidenses. [9]
— Glenn T. Seaborg
Al ser el primero del segundo centenar de elementos químicos, se decidió que el elemento se llamaría «mendelevio» en honor al químico ruso Dmitri Mendeléyev , padre de la tabla periódica . Debido a que este descubrimiento se produjo durante la Guerra Fría , Seaborg tuvo que solicitar permiso al gobierno de los Estados Unidos para proponer que el elemento se llamara en honor a un ruso, pero le fue concedido. [6] El nombre "mendelevio" fue aceptado por la Unión Internacional de Química Pura y Aplicada (IUPAC) en 1955 con el símbolo "Mv", [10] que fue cambiado a "Md" en la siguiente Asamblea General de la IUPAC (París, 1957). [11]
En la tabla periódica , el mendelevio se encuentra a la derecha del actínido fermio , a la izquierda del actínido nobelio y debajo del lantánido tulio . El mendelevio metálico aún no se ha preparado en grandes cantidades y actualmente es imposible hacerlo. [13] Sin embargo, se han realizado varias predicciones y algunos resultados experimentales preliminares con respecto a sus propiedades. [13]
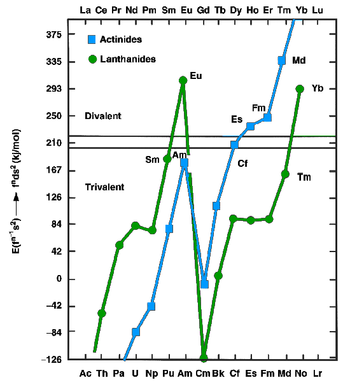
Los lantánidos y actínidos, en estado metálico, pueden existir como metales divalentes (como el europio y el iterbio ) o trivalentes (la mayoría de los demás lantánidos). Los primeros tienen configuraciones f n s 2 , mientras que los segundos tienen configuraciones f n −1 d 1 s 2 . En 1975, Johansson y Rosengren examinaron los valores medidos y predichos para las energías cohesivas ( entalpías de cristalización) de los lantánidos y actínidos metálicos , tanto como metales divalentes como trivalentes. [14] [15] La conclusión fue que la mayor energía de enlace de la configuración [Rn]5f 12 6d 1 7s 2 sobre la configuración [Rn]5f 13 7s 2 para el mendelevio no fue suficiente para compensar la energía necesaria para promover un electrón 5f a 6d, como también es cierto para los actínidos muy tardíos: por lo tanto, se esperaba que el einstenio , el fermio , el mendelevio y el nobelio fueran metales divalentes. [14] El predominio creciente del estado divalente mucho antes de que concluya la serie de actínidos se atribuye a la estabilización relativista de los electrones 5f, que aumenta con el aumento del número atómico. [16] Los estudios termocromatográficos con trazas de mendelevio realizados por Zvara y Hübener de 1976 a 1982 confirmaron esta predicción. [13] En 1990, Haire y Gibson estimaron que el metal mendelevio tenía una entalpía de sublimación entre 134 y 142 kJ/mol. [13] El metal mendelevio divalente debería tener un radio metálico de alrededor de194 ± 10 pm . [13] Al igual que los otros actínidos tardíos divalentes (excepto el nuevamente trivalente lawrencio ), el mendelevio metálico debería asumir una estructura cristalina cúbica centrada en las caras . [1] El punto de fusión del mendelevio se ha estimado en 800 °C, el mismo valor que el predicho para el elemento vecino nobelio. [17] Se predice que su densidad será de alrededor de10,3 ± 0,7 g/cm3 . [ 1]
La química del mendelevio se conoce principalmente solo en solución, en la que puede adoptar los estados de oxidación +3 o +2 . También se ha informado del estado +1, pero aún no se ha confirmado. [18]
Antes del descubrimiento del mendelevio, Seaborg y Katz predijeron que debería ser predominantemente trivalente en solución acuosa y, por lo tanto, debería comportarse de manera similar a otros lantánidos y actínidos tripositivos. Después de la síntesis del mendelevio en 1955, estas predicciones se confirmaron, primero en la observación en su descubrimiento de que eluía justo después del fermio en la secuencia de elución de actínidos trivalentes de una columna de resina de intercambio catiónico, y más tarde la observación de 1967 de que el mendelevio podía formar hidróxidos y fluoruros insolubles que coprecipitaban con sales de lantánidos trivalentes. [18] Los estudios de intercambio catiónico y extracción con solventes llevaron a la conclusión de que el mendelevio era un actínido trivalente con un radio iónico algo menor que el del actínido anterior, el fermio. [18] El mendelevio puede formar complejos de coordinación con ácido 1,2-ciclohexanodinitrilotetraacético (DCTA). [18]
En condiciones reductoras , el mendelevio(III) se puede reducir fácilmente a mendelevio(II), que es estable en solución acuosa. [18] El potencial de reducción estándar del par E °(Md 3+ →Md 2+ ) se estimó de diversas formas en 1967 como −0,10 V o −0,20 V: [18] experimentos posteriores de 2013 establecieron el valor como−0,16 ± 0,05 V. [ 19] En comparación, E °(Md 3+ →Md 0 ) debería estar alrededor de −1,74 V, y E °(Md 2+ →Md 0 ) debería estar alrededor de −2,5 V. [18] El comportamiento de elución del mendelevio (II) se ha comparado con el del estroncio (II) y el europio (II). [18]
En 1973, se informó que científicos rusos habían producido mendelevio (I), quienes lo obtuvieron al reducir estados de oxidación más altos de mendelevio con samario (II). Se encontró que era estable en una solución neutra de agua y etanol y que era homólogo del cesio (I). Sin embargo, experimentos posteriores no encontraron evidencia de mendelevio (I) y descubrieron que el mendelevio se comportaba como elementos divalentes cuando se reducía, no como los metales alcalinos monovalentes . [18] Sin embargo, el equipo ruso realizó estudios adicionales sobre la termodinámica de la cocristalización de mendelevio con cloruros de metales alcalinos y concluyó que el mendelevio (I) se había formado y podía formar cristales mixtos con elementos divalentes, cocristalizándose así con ellos. El estado del estado de oxidación +1 aún es tentativo. [18]
En 1975 se predijo que el potencial del electrodo E °(Md 4+ →Md 3+ ) sería +5,4 V; los experimentos de 1967 con el fuerte agente oxidante bismutato de sodio no pudieron oxidar el mendelevio (III) a mendelevio (IV). [18]
Un átomo de mendelevio tiene 101 electrones. Se espera que estén dispuestos en la configuración [Rn]5f 13 7s 2 ( símbolo del término del estado fundamental 2 F 7/2 ), aunque la verificación experimental de esta configuración electrónica aún no se había realizado en 2006. Los quince electrones en las subcapas 5f y 7s son electrones de valencia . [20] Al formar compuestos, se pueden perder tres electrones de valencia, dejando atrás un núcleo [Rn]5f 12 : esto se ajusta a la tendencia establecida por los otros actínidos con sus configuraciones electrónicas [Rn] 5f n en el estado tripositivo. El primer potencial de ionización del mendelevio se midió como máximo (6,58 ± 0,07) eV en 1974, basándose en el supuesto de que los electrones 7s se ionizarían antes que los 5f; [21] Este valor no ha sido refinado aún más debido a la escasez y alta radiactividad del mendelevio. [22] El radio iónico del hexacoordinado Md 3+ se había estimado preliminarmente en 1978 en alrededor de 91,2 pm; [18] Los cálculos de 1988 basados en la tendencia logarítmica entre los coeficientes de distribución y el radio iónico produjeron un valor de 89,6 pm, así como una entalpía de hidratación de−3654 ± 12 kJ/mol . [18] Md 2+ debe tener un radio iónico de 115 pm y una entalpía de hidratación de −1413 kJ/mol; Md + debe tener un radio iónico de 117 pm. [18]
Se conocen diecisiete isótopos del mendelevio, con números másicos de 244 a 260; todos son radiactivos. [23] Además, se conocen 14 isómeros nucleares . [4] De estos, el isótopo de vida más larga es el 258 Md con una vida media de 51,59 días, y el isómero de vida más larga es el 258m Md con una vida media de 57,0 minutos. [4] Sin embargo, el 256 Md de vida más corta (vida media de 1,295 horas) se utiliza con más frecuencia en la experimentación química porque se puede producir en mayores cantidades a partir de la irradiación de partículas alfa del einstenio. [23] Después del 258 Md, los siguientes isótopos de mendelevio más estables son el 260 Md con una vida media de 27,8 días, el 257 Md con una vida media de 5,52 horas, el 259 Md con una vida media de 1,60 horas y el 256 Md con una vida media de 1,295 horas. Todos los isótopos restantes del mendelevio tienen vidas medias inferiores a una hora, y la mayoría de ellos tienen vidas medias inferiores a 5 minutos. [4] [23]
Las vidas medias de los isótopos de mendelevio aumentan suavemente a partir de 244 Md en adelante, alcanzando un máximo a 258 Md. [4] [23] Los experimentos y predicciones sugieren que las vidas medias disminuirán luego, excepto 260 Md con una vida media de 27,8 días, [4] [23] a medida que la fisión espontánea se convierte en el modo de desintegración dominante [4] debido a la repulsión mutua de los protones que plantea un límite a la isla de estabilidad relativa de los núcleos de larga vida en la serie de los actínidos . [24] Además, el mendelevio es el elemento con el número atómico más alto que tiene un isótopo conocido con una vida media superior a un día. [4]
El mendelevio-256, el isótopo químicamente más importante del mendelevio, se desintegra mediante captura de electrones el 90% del tiempo y mediante desintegración alfa el 10% del tiempo. [23] Se detecta más fácilmente a través de la fisión espontánea de su hija de captura de electrones, el fermio-256 , pero en presencia de otros nucleidos que experimentan fisión espontánea, las desintegraciones alfa a las energías características del mendelevio-256 (7,205 y 7,139 MeV ) pueden proporcionar una identificación más útil. [25]
Los isótopos más ligeros ( 244 Md a 247 Md) se producen principalmente a través del bombardeo de objetivos de bismuto con iones de argón , mientras que los ligeramente más pesados ( 248 Md a 253 Md) se producen bombardeando objetivos de plutonio y americio con iones de carbono y nitrógeno . Los isótopos más importantes y más estables están en el rango de 254 Md a 258 Md y se producen a través del bombardeo de einstenio con partículas alfa: se pueden usar einstenio-253, −254 y −255. 259 Md se produce como un hijo de 259 No , y 260 Md se puede producir en una reacción de transferencia entre einstenio-254 y oxígeno-18 . [23] Normalmente, el isótopo 256 Md más utilizado se produce bombardeando einstenio-253 o −254 con partículas alfa: se prefiere el einstenio-254 cuando está disponible porque tiene una vida media más larga y, por lo tanto, se puede utilizar como objetivo durante más tiempo. [23] Utilizando cantidades disponibles de microgramos de einstenio, se pueden producir cantidades de femtogramos de mendelevio-256. [23]
El momento de retroceso de los átomos de mendelevio-256 producidos se utiliza para alejarlos físicamente del objetivo de einstenio del que se producen, llevándolos a una fina lámina de metal (normalmente berilio , aluminio , platino u oro ) justo detrás del objetivo en el vacío. [25] Esto elimina la necesidad de una separación química inmediata, que es costosa y evita la reutilización del costoso objetivo de einstenio. [25] Los átomos de mendelevio quedan atrapados en una atmósfera de gas (frecuentemente helio ), y un chorro de gas de una pequeña abertura en la cámara de reacción transporta el mendelevio. [25] Utilizando un tubo capilar largo , e incluyendo aerosoles de cloruro de potasio en el gas helio, los átomos de mendelevio pueden transportarse a lo largo de decenas de metros para analizarlos químicamente y determinar su cantidad. [8] [25] El mendelevio puede entonces separarse del material de la lámina y otros productos de fisión aplicando ácido a la lámina y luego coprecipitando el mendelevio con fluoruro de lantano , luego usando una columna de resina de intercambio catiónico con una solución de etanol al 10% saturada con ácido clorhídrico , que actúa como eluyente . Sin embargo, si la lámina está hecha de oro y es lo suficientemente delgada, es suficiente simplemente disolver el oro en agua regia antes de separar los actínidos trivalentes del oro usando cromatografía de intercambio aniónico , siendo el eluyente ácido clorhídrico 6 M. [25]
El mendelevio puede finalmente separarse de los otros actínidos trivalentes mediante elución selectiva a partir de una columna de resina de intercambio catiónico, siendo el eluyente amoniaco α-HIB. [25] El uso del método de chorro de gas a menudo hace innecesarios los dos primeros pasos. [25] El procedimiento anterior es el más comúnmente utilizado para la separación de elementos transeinstenio. [25]
Otra forma posible de separar los actínidos trivalentes es mediante cromatografía de extracción con disolventes utilizando ácido bis-(2-etilhexil)fosfórico (abreviado como HDEHP) como fase orgánica estacionaria y ácido nítrico como fase acuosa móvil. La secuencia de elución de los actínidos se invierte con respecto a la de la columna de resina de intercambio catiónico, de modo que los actínidos más pesados se eluyen más tarde. El mendelevio separado por este método tiene la ventaja de estar libre de agente complejante orgánico en comparación con la columna de resina; la desventaja es que el mendelevio se eluye muy tarde en la secuencia de elución, después del fermio. [8] [25]
Otro método para aislar el mendelevio explota las propiedades de elución distintas de Md 2+ de las de Es 3+ y Fm 3+ . Los pasos iniciales son los mismos que los anteriores, y emplea HDEHP para la cromatografía de extracción, pero coprecipita el mendelevio con fluoruro de terbio en lugar de fluoruro de lantano. Luego, se agregan 50 mg de cromo al mendelevio para reducirlo al estado +2 en ácido clorhídrico 0,1 M con zinc o mercurio . [25] Luego procede la extracción con solvente, y mientras que los lantánidos y actínidos trivalentes y tetravalentes permanecen en la columna, el mendelevio (II) no lo hace y permanece en el ácido clorhídrico. Luego se reoxida al estado +3 usando peróxido de hidrógeno y luego se aísla por elución selectiva con ácido clorhídrico 2 M (para eliminar impurezas, incluido el cromo) y finalmente ácido clorhídrico 6 M (para eliminar el mendelevio). [25] También es posible utilizar una columna de cationito y amalgama de zinc, utilizando ácido clorhídrico 1 M como eluyente, reduciendo Md(III) a Md(II) donde se comporta como los metales alcalinotérreos . [25] El aislamiento químico termocromatográfico podría lograrse utilizando el hexafluoroacetilacetonato de mendelevio volátil : el compuesto análogo de fermio también es conocido y también es volátil. [25]
Aunque pocas personas entran en contacto con el mendelevio, la Comisión Internacional de Protección Radiológica ha establecido límites de exposición anuales para el isótopo más estable. Para el mendelevio-258, el límite de ingestión se fijó en 9×10 5 becquerelios (1 Bq = 1 desintegración por segundo). Dada la vida media de este isótopo, esto es sólo 2,48 ng (nanogramos). El límite de inhalación está en 6000 Bq o 16,5 pg (picogramo). [26]
{{cite book}}: |journal=ignorado ( ayuda )