La reacción de Sandmeyer es una reacción química utilizada para sintetizar haluros de arilo a partir de sales de aril diazonio utilizando sales de cobre como reactivos o catalizadores. [1] [2] [3] [4] Es un ejemplo de una sustitución aromática radical-nucleófila . La reacción de Sandmeyer proporciona un método a través del cual se pueden realizar transformaciones únicas en el benceno, como halogenación , cianación , trifluorometilación e hidroxilación .
La reacción fue descubierta en 1884 por el químico suizo Traugott Sandmeyer , cuando intentó sintetizar fenilacetileno a partir de cloruro de bencenodiazonio y acetiluro de cobre(I) . En cambio, el principal producto que aisló fue clorobenceno . [5] En la época moderna, la reacción de Sandmeyer se refiere a cualquier método de sustitución de un grupo amino aromático mediante la preparación de su sal de diazonio seguida de su desplazamiento con un nucleófilo en presencia de sales catalíticas de cobre(I).
Las reacciones de Sandmeyer más comúnmente empleadas son las reacciones de cloración, bromación, cianación e hidroxilación usando CuCl , CuBr , CuCN y Cu 2 O , respectivamente. Más recientemente, se ha desarrollado la trifluorometilación de sales de diazonio y se la conoce como una reacción "tipo Sandmeyer". Las sales de diazonio también reaccionan con boronatos, yoduro, tioles , agua, ácido hipofosforoso y otros, [6] y la fluoración se puede llevar a cabo usando aniones tetrafluoroborato ( reacción de Balz-Schiemann ). Sin embargo, dado que estos procesos no requieren un catalizador metálico, generalmente no se los conoce como reacciones de Sandmeyer. En numerosas variantes que se han desarrollado, también se han empleado otras sales de metales de transición, incluyendo cobre (II), hierro (III) y cobalto (III). [7] Debido a su amplia aplicabilidad sintética, la reacción de Sandmeyer, junto con otras transformaciones de compuestos de diazonio, es complementaria a la sustitución aromática electrofílica .
La reacción de Sandmeyer es un ejemplo de una sustitución aromática radical-nucleófila (S RN Ar). El mecanismo radical de la reacción de Sandmeyer está respaldado por la detección de subproductos de biarilo . [8] La sustitución del grupo diazo aromático con un halógeno o pseudohalógeno se inicia mediante un mecanismo de transferencia de un electrón catalizado por cobre (I) para formar un radical arilo con pérdida de gas nitrógeno. [9] [10] [11] [8] El areno sustituido posiblemente se forma por transferencia directa de Cl, Br, CN u OH desde una especie de cobre (II) al radical arilo para producir el areno sustituido y regenerar el catalizador de cobre (I). En una propuesta alternativa, un intermedio transitorio de cobre (III), formado a partir del acoplamiento del radical arilo con la especie de cobre (II), sufre una eliminación reductora rápida para proporcionar el producto y regenerar cobre (I). [12] [13] [14] Sin embargo, la evidencia de un intermediario de organocobre es débil y mayormente circunstancial, [15] [16] y la vía exacta puede depender del sustrato y las condiciones de reacción.
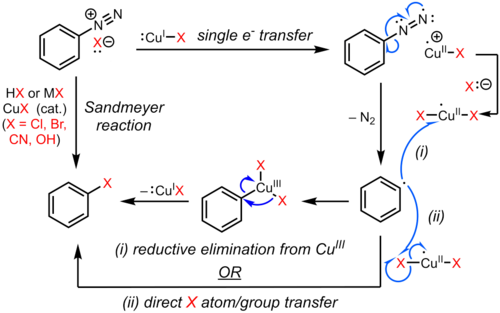
Se han desarrollado variaciones de la reacción de Sandmeyer para que se adapten a múltiples aplicaciones sintéticas. Estas reacciones suelen proceder de la formación de una sal de arildiazonio seguida de una reacción con una sal de cobre(I) para producir un areno sustituido:
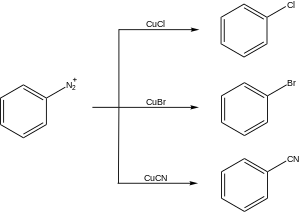
Hay muchas aplicaciones sintéticas de la reacción de Sandmeyer.
Uno de los usos más importantes de la reacción de Sandmeyer es la formación de haluros de arilo. El disolvente de elección para la síntesis de yodoarenos es el diyodometano , [17] [18] mientras que para la síntesis de bromoarenos se utiliza bromoformo . Para la síntesis de cloroarenos , el cloroformo es el disolvente de elección. [19] La síntesis de (+)-curcufenol, un compuesto bioactivo que muestra actividad antifúngica y anticancerígena, emplea la reacción de Sandmeyer para sustituir un grupo amina por un grupo bromo. [20]

Un protocolo de bromación emplea una mezcla de Cu(I)/Cu(II) con cantidades adicionales del ligando bidentado fenantrolina y el catalizador de transferencia de fase dibenzo-18-corona-6 para convertir una sal de tetrafluoroborato de diazonio arílico en un bromuro de arilo. [21]
La reacción de Balz-Schiemann utiliza tetrafluoroborato y produce el producto sustituido con haluro, fluorobenceno , que no se obtiene mediante el uso de fluoruros de cobre . Esta reacción muestra motivos característicos de la reacción de Sandmeyer. [22]
Otro uso de la reacción de Sandmeyer es la cianación , que permite la formación de benzonitrilos , una clase importante de compuestos orgánicos. Un intermediario clave en la síntesis del fármaco antipsicótico Fluanxol se sintetiza mediante una cianación a través de la reacción de Sandmeyer. [23]

La reacción de Sandmeyer también se ha empleado en la síntesis de neoanfimedina, un compuesto que se sugiere que actúa sobre la topoisomerasa II como fármaco contra el cáncer. [24]

Se ha demostrado que las reacciones de tipo Sandmeyer se pueden utilizar para generar compuestos arílicos funcionalizados por grupos sustituyentes trifluorometilo. Este proceso de trifluorometilación proporciona propiedades químicas únicas con una amplia variedad de aplicaciones prácticas. En particular, los productos farmacéuticos con grupos CF3 tienen una estabilidad metabólica , lipofilicidad y biodisponibilidad mejoradas . Las reacciones de trifluorometilación de tipo Sandmeyer presentan condiciones de reacción suaves y una mayor tolerancia a los grupos funcionales en relación con los métodos anteriores de trifluorometilación. [25] [26] A continuación se presenta un ejemplo de una reacción de trifluorometilación de tipo Sandmeyer. [27]

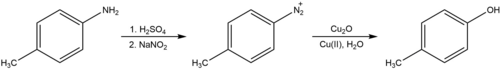
La reacción de Sandmeyer también se puede utilizar para convertir aminas arílicas en fenoles mediante la formación de una sal de arildiazonio. En presencia de un catalizador de cobre, como óxido de cobre(I) , y un exceso de nitrato de cobre(II) , esta reacción se lleva a cabo fácilmente en agua neutra a temperatura ambiente. [28] Esto contrasta con el procedimiento clásico (conocido por el nombre alemán Verkochung ), que requiere hervir la sal de diazonio en ácido acuoso, un proceso que se cree que involucra el catión arilo en lugar del radical y se sabe que genera otros productos secundarios de adición nucleofílica además del producto de hidroxilación deseado.
{{cite book}}: CS1 maint: falta la ubicación del editor ( enlace ) CS1 maint: varios nombres: lista de autores ( enlace )