En síntesis orgánica , la cianación es la unión o sustitución de un grupo cianuro en varios sustratos . Estas transformaciones son de gran valor porque generan enlaces CC. Además, los nitrilos son grupos funcionales versátiles.
Por lo general, los nitrilos de alquilo se forman mediante cianación de tipo S N 1 o S N 2 con electrófilos de alquilo. Un ejemplo ilustrativo es la síntesis de cianuro de bencilo mediante la reacción de cloruro de bencilo y cianuro de sodio. [1] En algunos casos se utiliza cianuro cuproso en lugar de cianuro de sodio. [2]
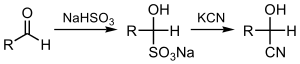
La cianación de cetonas o aldehídos produce las cianhidrinas correspondientes , lo que se puede hacer directamente con el ion cianuro ( reacción de la cianhidrina ) o utilizando bisulfito, seguido del desplazamiento del sulfito: [3] [4]
Una reacción relacionada es la hidrocianación , que instala los elementos de H-CN.
La cianación de arenos ofrece acceso a derivados del ácido benzoico , así como la utilidad de los propios arilnitrilos como productos químicos finos:

Se conocen diversas vías mecánicamente distintas para cianar arenos:
Si bien la reacción clásica de Rosenmund Von-Braun utiliza cianuro de cobre (I) estequiométrico como fuente de cianación, [5] se han desarrollado variantes más nuevas que son catalíticas en cobre : [6]

Además, se han explorado ampliamente las cianaciones de haluros de arilo catalizadas por paladio . Generalmente, se utilizan KCN o su sustituto menos tóxico Zn(CN) 2 como fuentes de cianuro nucleófilo . Para disminuir aún más las preocupaciones por la toxicidad , también se ha utilizado ferricianuro de potasio como fuente de cianuro. Se cree que los ciclos catalíticos proceden a través de una vía estándar de Pd (O/II) con eliminación reductora que forja el enlace CC clave. La desactivación de Pd(II) con exceso de cianuro es un problema común. [7] Se han desarrollado condiciones de catálisis de paladio para yoduros, bromuros e incluso cloruros de arilo: [8]

Las cianaciones catalizadas por níquel evitan el uso de metales preciosos y pueden aprovechar el cianuro de bencilo o el acetonitrilo como fuente de cianuro, a través de la escisión reductora del enlace CC: [9]

La cianación de Sandmeyer es un medio para convertir derivados de anilina en benzonitrilos. [10] En general, se postula que la cianación es de dos electrones, mientras que con mediadores radicales en ausencia de metales, la reacción probablemente sea radical. [11]
Los arenos metalizados se pueden cianurar con fuentes de cianuro electrofílico , incluidas las cianamidas , los cianatos , el dimetilmalononitrilo o el etoximetilencianoacetato de etilo. Estos métodos pueden realizarse con o sin mediación de metales de transición: [12]

Se conocen métodos radicales para la cianación de CH de areno . Los mediadores fotorredox (metálicos u orgánicos) son los más comunes: [13] [14]
