El nitrato de cobre (II) describe cualquier miembro de la familia de compuestos inorgánicos con la fórmula Cu ( NO 3 ) 2 (H 2 O) x . Los hidratos son sólidos azules . El nitrato de cobre anhidro forma cristales azul-verdes y sublima en vacío a 150-200 °C. [5] [6] Los hidratos comunes son el hemipentahidrato y el trihidrato.
El nitrato de cobre hidratado se prepara tratando el metal de cobre o su óxido con ácido nítrico : [7]
Las mismas sales se pueden preparar tratando el cobre metálico con una solución acuosa de nitrato de plata . Esa reacción ilustra la capacidad del cobre metálico para reducir los iones de plata.
En solución acuosa, los hidratos existen como el complejo acuoso [Cu(H 2 O) 6 ] 2+ . Estos complejos son altamente lábiles y están sujetos a un rápido intercambio de ligandos debido a la configuración electrónica d 9 del cobre (II).
La deshidratación de cualquiera de los nitratos de cobre(II) hidratados mediante calentamiento produce óxidos, no Cu(NO 3 ) 2 . [6] A 80 °C, los hidratos se convierten en "nitrato de cobre básico", Cu 2 (NO 3 )(OH) 3 , que se convierte en CuO a 180 °C. [7] Aprovechando esta reactividad, el nitrato de cobre se puede utilizar para generar ácido nítrico calentándolo hasta su descomposición y pasando los vapores directamente al agua. Este método es similar al último paso del proceso de Ostwald . Las ecuaciones son las siguientes:
El tratamiento de soluciones de nitrato de cobre (II) con trifenilfosfina , trifenilarsina y trifenilestibina produce los correspondientes complejos de cobre (I) [Cu(EPh 3 ) 3 ]NO 3 (E = P, As, Sb; Ph = C 6 H 5 ). El ligando del grupo V se oxida al óxido. [8]
El Cu(NO3 ) 2 anhidro es uno de los pocos nitratos de metales de transición anhidros. [9] No se puede preparar mediante reacciones que contengan o produzcan agua. En cambio, el Cu(NO3 ) 2 anhidro se forma cuando el metal de cobre se trata con tetróxido de dinitrógeno : [6]
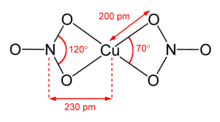
Se conocen dos polimorfos de nitrato de cobre(II) anhidro, α y β. [6] Ambos polimorfos son redes poliméricas de coordinación tridimensionales con cadenas infinitas de centros de cobre(II) y grupos nitrato. La forma α tiene solo un entorno de Cu, con coordinación [4+1], [1] pero la forma β tiene dos centros de cobre diferentes, uno con [4+1] y otro que es plano-cuadrado. [2]
El solvato de nitrometano también presenta "coordinación [4+1]", con cuatro enlaces Cu-O cortos de aproximadamente 200 pm y un enlace más largo de 240 pm. [10]
El calentamiento del nitrato de cobre (II) anhidro sólido al vacío a 150-200 °C conduce a la sublimación y al " craqueo " para dar un vapor de moléculas de nitrato de cobre (II) monomérico. [6] [11] En la fase de vapor, la molécula presenta dos ligandos de nitrato bidentados. [12]
Se han descrito cinco hidratos : el monohidrato ( Cu(NO 3 ) 2 ·2H 2 O ), [2] el sesquihidrato ( Cu(NO 3 ) 2 ·1,5H 2 O ), [13] el hemipentahidrato ( Cu(NO 3 ) 2 ·2,5H 2 O ), [14] un trihidrato ( Cu(NO 3 ) 2 ·3H 2 O ), [15] y un hexahidrato ( [Cu(OH 2 ) 6 ](NO 3 ) 2 . [16] La estructura cristalina del hexahidrato parecía mostrar seis distancias Cu–O casi iguales, sin revelar el efecto habitual de una distorsión de Jahn-Teller que es característica de los complejos octaédricos de Cu(II). Esta falta de efecto se atribuyó al fuerte enlace de hidrógeno que limita la elasticidad de los enlaces Cu-O, pero probablemente se deba a que el níquel se identificó erróneamente como cobre en el refinamiento.
El nitrato de cobre (II) tiene diversas aplicaciones, siendo la principal su conversión en óxido de cobre (II) , que se utiliza como catalizador para diversos procesos en química orgánica . Sus soluciones se utilizan en textiles y como agente de pulido para otros metales. Los nitratos de cobre se encuentran en algunos productos pirotécnicos . [7] A menudo se utiliza en los laboratorios escolares para demostrar las reacciones químicas de las celdas voltaicas . Es un componente de algunos esmaltes cerámicos y pátinas metálicas.
El nitrato de cobre, en combinación con anhídrido acético , es un reactivo eficaz para la nitración de compuestos aromáticos , conocida como nitración de Menke . [17] El nitrato de cobre hidratado adsorbido sobre arcilla proporciona un reactivo llamado "Claycop". La arcilla de color azul resultante se utiliza como suspensión, por ejemplo para la oxidación de tioles a disulfuros . El Claycop también se utiliza para convertir ditioacetales en carbonilos. [18] Un reactivo relacionado basado en montmorillonita ha demostrado ser útil para la nitración de compuestos aromáticos. [19]
El nitrato de cobre (II) también se puede utilizar para la electroobtención de cobre a pequeña escala con amoníaco (NH 3 ) como subproducto. [20]
No se conoce ningún mineral con la fórmula ideal de Cu(NO 3 ) , ni tampoco sus hidratos. La licasita, Cu 3 (NO 3 )(OH) 5 ·2H 2 O y la buttgenbachita, Cu 19 (NO 3 ) 2 (OH) 32 Cl 4 ·2H 2 O son minerales relacionados. [21] [22]
Los nitratos de cobre básicos naturales incluyen los minerales raros gerhardtita y rouaíta, ambos polimorfos de Cu 2 (NO 3 )(OH) 3 . [23] [24] [25] Una sal natural mucho más compleja, básica, hidratada y que contiene cloruro es la buttgenbachita. [22] [25]