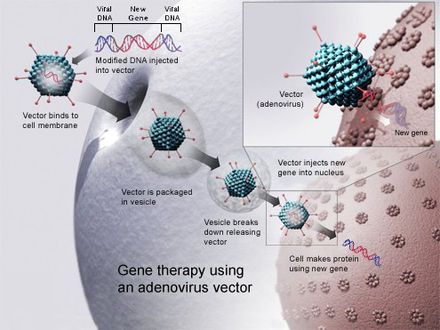
El dopaje genético es el uso hipotético no terapéutico de la terapia génica por parte de atletas con el fin de mejorar su rendimiento en aquellos eventos deportivos que prohíben tales aplicaciones de la tecnología de modificación genética, [1] [2] y por razones distintas al tratamiento de una enfermedad. En abril de 2015 [update], no hay evidencia de que el dopaje genético se haya utilizado para mejorar el rendimiento atlético en ningún evento deportivo. [1] El dopaje genético implicaría el uso de la transferencia genética para aumentar o disminuir la expresión genética y la biosíntesis de una proteína humana específica; esto podría hacerse inyectando directamente el portador del gen en la persona, o tomando células de la persona, transfectándolas y administrándolas nuevamente a la persona. [1]
El desarrollo histórico del interés por el dopaje genético por parte de los deportistas y la preocupación por los riesgos del dopaje genético y cómo detectarlo avanzó en paralelo con el desarrollo del campo de la terapia génica, especialmente con la publicación en 1998 de un trabajo sobre un ratón transgénico que sobreexpresa insulina. -como el factor de crecimiento 1 que era mucho más fuerte que los ratones normales, incluso en la vejez, los estudios preclínicos publicados en 2002 sobre una forma de administrar eritropoyetina (EPO) mediante terapia génica y la publicación en 2004 de la creación de un "ratón maratón" con resistencia mucho mayor que la de los ratones normales, creada mediante la entrega del gen que expresa PPAR gamma a los ratones. Todos los científicos que generaron estas publicaciones fueron contactados directamente por atletas y entrenadores que buscaban acceso a la tecnología. El público se dio cuenta de esa actividad en 2006, cuando dichos esfuerzos formaron parte de las pruebas presentadas en el juicio de un entrenador alemán.
Los propios científicos, así como organismos como la Agencia Mundial Antidopaje (AMA), el Comité Olímpico Internacional y la Asociación Estadounidense para el Avance de la Ciencia , comenzaron a discutir el riesgo del dopaje genético en 2001, y en 2003 la AMA había añadido genes. el dopaje en la lista de prácticas de dopaje prohibidas y poco después comenzó a financiar investigaciones sobre métodos para detectar el dopaje genético.
La mejora genética incluye la manipulación de genes o la transferencia de genes por parte de atletas sanos con el fin de mejorar físicamente su rendimiento. La mejora genética incluye el dopaje genético y tiene potencial de abuso entre los atletas, al tiempo que abre la puerta a la controversia política y ética. [3]
La historia de la preocupación por el potencial del dopaje genético sigue la historia de la terapia génica , el uso médico de genes para tratar enfermedades, que se probó clínicamente por primera vez en la década de 1990. [4] El interés de la comunidad atlética fue especialmente estimulado por la creación en un laboratorio universitario de un "ratón poderoso", creado mediante la administración de un virus que porta el gen que expresa el factor de crecimiento similar a la insulina 1 a ratones; los ratones eran más fuertes y se mantuvieron fuertes incluso a medida que envejecían, sin ejercicio. [4] El laboratorio había estado buscando tratamientos para enfermedades de desgaste muscular , pero cuando su trabajo se hizo público, el laboratorio se vio inundado de llamadas de atletas que buscaban el tratamiento, y un entrenador ofreció todo su equipo. [5] El científico dijo al New York Times en 2007: "Me sorprendió bastante, debo admitir. La gente intentaba seducirme, diciendo cosas como: 'Te ayudará a avanzar en tu investigación'. Algunos se ofrecieron a pagarme". También le dijo al Times que cada vez que se publica una investigación similar recibe llamadas y que explica que, incluso si el tratamiento estuviera listo para su uso en personas, lo que llevaría años, habría riesgos graves, incluida la muerte; También dijo que incluso después de explicar esto, los atletas todavía lo quieren. [5]
En 1999, el campo de la terapia génica sufrió un retroceso cuando Jesse Gelsinger murió en un ensayo clínico de terapia génica, sufriendo una reacción inflamatoria masiva al fármaco. [4] [6] Esto llevó a las autoridades reguladoras de EE. UU. y Europa a aumentar los requisitos de seguridad en los ensayos clínicos incluso más allá de las restricciones iniciales que se habían establecido al comienzo de la era de la biotecnología para hacer frente a los riesgos del ADN recombinante . [7]
En junio de 2001, Theodore Friedmann, uno de los pioneros de la terapia genética, y Johann Olav Koss, medallista de oro olímpico en patinaje de velocidad, publicaron un artículo que fue la primera advertencia pública sobre el dopaje genético. [7] [8] También en junio de 2001, un grupo de trabajo sobre terapia génica, convocado por la Comisión Médica del Comité Olímpico Internacional, señaló que "somos conscientes de que existe la posibilidad de que se abuse de los medicamentos de terapia génica y comenzaremos a establecer procedimientos y métodos de prueba de última generación para identificar a los atletas que podrían hacer un mal uso de dicha tecnología". [7]
En 2002 se publicó una investigación sobre una terapia génica preclínica llamada Repoxygen , que administraba el gen que codifica la eritropoyetina (EPO) como posible tratamiento para la anemia . [4] Los científicos de esa empresa también recibieron llamadas de atletas y entrenadores. [4] Ese mismo año, la Agencia Mundial Antidopaje celebró su primera reunión para discutir el riesgo del dopaje genético, [7] [9] y el Consejo de Bioética del Presidente de los EE. UU . discutió el dopaje genético en el contexto de la mejora humana en varias sesiones. . [10] [11] [12]
En 2003, el campo de la terapia génica dio un paso adelante y un paso atrás; Se aprobó el primer fármaco de terapia génica, Gendicine , que fue aprobado en China para el tratamiento de ciertos cánceres, [13] pero los niños en Francia que aparentemente habían sido tratados con terapia génica para inmunodeficiencia combinada grave (no humana) comenzaron a desarrollar leucemia. [6] En 2003 se hizo público el escándalo BALCO , en el que químicos, entrenadores y atletas conspiraron para evadir los controles de dopaje con sustancias dopantes nuevas e indetectables. [7] En 2003, la Agencia Mundial de Dopaje añadió proactivamente el dopaje genético a la lista de prácticas de dopaje prohibidas. [4] También en 2003, un simposio convocado por la Asociación Estadounidense para el Avance de la Ciencia se centró en el tema. [14]
Una investigación publicada en 2004 demostró que los ratones que recibieron terapia génica que codifica una proteína llamada PPAR gamma tenían aproximadamente el doble de resistencia que los ratones no tratados y fueron denominados "ratones maratón"; esos científicos recibieron llamadas de atletas y entrenadores. [4] También en 2004, la Agencia Mundial Antidopaje comenzó a financiar investigaciones para detectar el dopaje genético y formó un panel permanente de expertos para asesorarla sobre los riesgos y orientar la financiación. [4] [9]
En 2006, el interés de los atletas por el dopaje genético recibió una amplia cobertura mediática debido a su mención durante el juicio de un entrenador alemán que fue acusado y declarado culpable de administrar a sus atletas drogas para mejorar el rendimiento sin su conocimiento; Un fiscal leyó en audiencia pública un correo electrónico en el que el entrenador intentaba obtener Repoxygen. [4] [5] Esta fue la primera revelación pública de que los atletas estaban interesados en el dopaje genético. [4]
En 2011 se aprobó el segundo fármaco de terapia génica; Neovasculgen , que administra el gen que codifica VEGF , fue aprobado en Rusia para tratar la enfermedad arterial periférica . [15] [16]
En 2012 , Glybera , un tratamiento para un trastorno hereditario poco común , se convirtió en el primer tratamiento aprobado para uso clínico en Europa o Estados Unidos. [17] [18]
A medida que el campo de la terapia génica ha ido evolucionando, ha aumentado el riesgo de que el dopaje genético se convierta en una realidad. [6]
Existen numerosos genes de interés como agentes de dopaje genético. [1] [19] [7] Incluyen eritropoyetina , factor de crecimiento similar a la insulina 1 , hormona de crecimiento humano , miostatina , factor de crecimiento endotelial vascular , factor de crecimiento de fibroblastos , endorfina , encefalina y alfa-actinina-3 . [1] [19]
Los riesgos del dopaje genético serían similares a los de la terapia génica: reacción inmune a la proteína nativa que conduce al equivalente de una enfermedad genética , respuesta inflamatoria masiva, cáncer y muerte, y en todos los casos, estos riesgos se asumirían por breve tiempo. ganancia a largo plazo en lugar de tratar una enfermedad grave. [6] [7]
La alfa-actinina-3 se encuentra sólo en el músculo esquelético de los seres humanos y en varios estudios genéticos se ha identificado que tiene un polimorfismo diferente en los atletas de talla mundial en comparación con las personas normales. Una forma que hace que el gen produzca más proteínas se encuentra en los velocistas y está relacionada con una mayor potencia; Otra forma que hace que el gen produzca menos proteínas se encuentra en los atletas de resistencia. [19] [20] Los agentes de dopaje genético podrían diseñarse con polimorfismo o, para los atletas de resistencia, alguna construcción de ADN que interfiriera con la expresión como un pequeño ARN de interferencia . [19]
La miostatina es una proteína responsable de inhibir la diferenciación y el crecimiento muscular . Eliminar el gen de la miostatina o limitar su expresión de otro modo conduce a un aumento del tamaño y la potencia de los músculos. [6] Esto se ha demostrado en ratones knockout que carecen del gen que fueron denominados " ratones Schwarzenegger ". [21] Los seres humanos nacidos con genes defectuosos también pueden servir como "modelos knockout"; Un niño alemán con una mutación en ambas copias del gen de la miostatina nació con músculos bien desarrollados. [22] El crecimiento muscular avanzado continuó después del nacimiento, y el niño podía levantar pesas de 3 kg a la edad de 4 años. [6] En un trabajo publicado en 2009, los científicos administraron folistatina mediante terapia génica al cuádriceps de primates no humanos. lo que resulta en un crecimiento muscular local similar al de los ratones. [6]
La eritropoyetina es una glicoproteína que actúa como hormona , controlando la producción de glóbulos rojos. Los deportistas se inyectan la proteína EPO desde hace muchos años como sustancia para mejorar el rendimiento ( dopaje sanguíneo ). Cuando la EPO adicional aumenta la producción de glóbulos rojos en circulación, aumenta la cantidad de oxígeno disponible para los músculos, mejorando la resistencia del atleta. [6] [23] Estudios recientes sugieren que puede ser posible introducir otro gen de EPO en un animal para aumentar la producción de EPO de forma endógena . [22] Los genes de EPO se han insertado con éxito en ratones y monos , y se descubrió que aumentan el hematocrito hasta en un 80 por ciento en esos animales. [22] Sin embargo, la EPO endógena y transgénica derivada provocó respuestas autoinmunes en algunos animales en forma de anemia grave . [22]
El factor de crecimiento similar a la insulina 1 es una proteína implicada en la mediación de la hormona del crecimiento . La administración de IGF-1 a ratones ha dado como resultado un mayor crecimiento muscular y una regeneración más rápida de músculos y nervios. [19] [6] Si los atletas usaran esto, la producción sostenida de IGF-1 podría causar enfermedades cardíacas y cáncer. [19]
La modulación de los niveles de proteínas que afectan la psicología también son objetivos potenciales del dopaje genético; por ejemplo, la percepción del dolor depende de las endorfinas y las encefalinas , la respuesta al estrés depende del BDNF y un aumento en la síntesis de monoaminas podría mejorar el estado de ánimo de los deportistas. [19] La preproencefalina se ha administrado mediante terapia génica utilizando un virus del herpes simple con replicación deficiente , que se dirige a los nervios, a ratones con resultados lo suficientemente buenos como para justificar un ensayo clínico de fase I en personas con cáncer terminal con dolor incontrolado. [6] Adoptar ese enfoque para los atletas sería problemático ya que la atenuación del dolor probablemente sería permanente. [6]
El VEGF ha sido probado en ensayos clínicos para aumentar el flujo sanguíneo y se ha considerado como un posible agente dopante genético; sin embargo, el seguimiento a largo plazo de los sujetos del ensayo clínico mostró malos resultados. [6] Lo mismo ocurre con el factor de crecimiento de fibroblastos . [6] El péptido 1 similar al glucagón aumenta la cantidad de glucosa en el hígado y se ha administrado mediante terapia génica a los hígados de modelos de diabetes en ratones y se demostró que aumenta la gluconeogénesis ; para los atletas, esto haría que haya más energía disponible y reduciría la acumulación de ácido láctico . [6]
La Agencia Mundial Antidopaje (AMA) es la principal organización reguladora que se ocupa de la cuestión de la detección del dopaje genético. [9] La organización está investigando métodos de prueba tanto directos como indirectos. La detección directa del uso de la terapia génica suele requerir el descubrimiento de proteínas recombinantes o vectores de inserción de genes , mientras que la mayoría de los métodos indirectos implican examinar al deportista en un intento de detectar cambios corporales o diferencias estructurales entre proteínas endógenas y recombinantes. [6] [24] [25]
Los métodos indirectos son por naturaleza más subjetivos, ya que resulta muy difícil determinar qué anomalías son prueba de dopaje genético y cuáles son simplemente propiedades biológicas naturales, aunque inusuales. [6] Por ejemplo, Eero Mäntyranta , un esquiador de fondo olímpico , tenía una mutación que hacía que su cuerpo produjera cantidades anormalmente altas de glóbulos rojos. Sería muy difícil determinar si los niveles de glóbulos rojos de Mäntyranta se debían o no a una ventaja genética innata o artificial. [26]
La idea de la detección del dopaje genético comenzó en 2004, cuando la AMA incluyó el dopaje genético en la lista prohibida y comenzó a investigar un nuevo método que puede detectar los transgenes insertados.
La primera generación de técnicas de detección de dopaje genético utilizaba pruebas de PCR dirigidas a las secuencias de los transgenes. Se puede obtener a partir de una muestra de sangre que contendrá ADN endógeno y transgén, ya que una pequeña cantidad del transgén se filtrará al torrente sanguíneo. Se puede distinguir fácilmente del ADN endógeno porque carece de intrones, ya que el transgén probablemente utilizará ADNc que se obtiene mediante transcriptasa inversa del ARN, que ha eliminado sus entones mediante el empalme del ARN dejando solo la unión exón-exón que incluye solo las secuencias codificantes y algunas secuencias importantes como promotores ya que el vencedor viral tiene una capacidad limitada. Por lo tanto, la PCR puede apuntar a estas uniones exón-exón como una secuencia única que no está presente en el ADNg [27]
La PCR tiene muchas aplicaciones en el campo de la biología molecular, incluido el análisis de ADN . El objetivo principal de la PCR es amplificar y duplicar exponencialmente las secuencias de ADN.
En la detección de dopaje genético, si la secuencia comenzó a amplificarse produciendo una gráfica exponencial, entonces la prueba es positiva e indica la presencia del gen en la muestra obtenida de esa persona. Pero si la secuencia no se amplificó y se produjo un gráfico lineal, entonces se dice que la prueba es negativa y la secuencia de ADN objetivo no estaba presente en la muestra de esa persona. [28]
Con la limitación de los métodos de detección de primera generación, era importante desarrollar un nuevo método que supere los fallos anteriores con una alta precisión y pueda detectar la manipulación en secuencias de ADN que podrían evadir la detección mediante métodos de PCR.
La solución fue utilizar el método de secuenciación de próxima generación (NGS) que puede determinar los órdenes de nucleótidos de todo el genoma o apuntar a las uniones exón-exón en el transgén y compararlo con la secuencia del gen de referencia. Este método es rápido y preciso y cada vez es más barato y ha abierto un nuevo campo en la ciencia que antes no era posible, como secuenciar todo el genoma. [29]
La secuenciación del ADN se estableció en la década de 1970 con la cromatografía bidimensional y siguió mejorando hasta 2001 con la finalización del proyecto del genoma humano que costó alrededor de tres mil millones de dólares y requirió 15 años para terminar de secuenciar el genoma completo. Sin embargo, con la tecnología de secuenciación actual, la secuenciación del genoma completo (WGS) tarda sólo un día y cuesta alrededor de mil dólares. Además, se está desarrollando una nueva tecnología de secuenciación que costará sólo 100 dólares para WGS. [30]
Existen muchas técnicas NGS que se utilizan en la secuenciación de ADN, pero el método más utilizado es el realizado por Illumina [31].
Una revisión de 2016 encontró que se habían identificado alrededor de 120 polimorfismos de ADN en la literatura relacionados con algún aspecto del rendimiento deportivo, 77 relacionados con la resistencia y 43 relacionados con la potencia. 11 se habían replicado en tres o más estudios y seis se identificaron en estudios de asociación de todo el genoma , pero 29 no se habían replicado en al menos un estudio. [20]
Los 11 marcadores replicados fueron: [20]
Los seis marcadores GWAS fueron: [20]
La Agencia Mundial Antidopaje (AMA) determinó que cualquier forma no terapéutica de manipulación genética para mejorar el rendimiento deportivo está prohibida según su código. Existen pautas para determinar si dicha tecnología debe prohibirse en el deporte: si se cumplen dos de las tres condiciones, entonces la tecnología está prohibida en el deporte (perjudicial para la salud, para mejorar el rendimiento y/o contra el "espíritu del deporte") . [32]
Kayser y cols. argumentan que el dopaje genético podría nivelar el campo de juego si todos los atletas tuvieran el mismo acceso. Los críticos afirman que cualquier intervención terapéutica con fines no terapéuticos o de mejora compromete los fundamentos éticos de la medicina y el deporte. [33]
Los elevados riesgos asociados a la terapia génica pueden verse superados por el potencial de salvar vidas de personas con enfermedades: según Alain Fischer, que participó en ensayos clínicos de terapia génica en niños con inmunodeficiencia combinada grave , "sólo las personas que están muriendo "Tengo motivos razonables para utilizarla. Utilizar la terapia génica para doparse es éticamente inaceptable y científicamente estúpido". [34] Como se ha visto en casos anteriores, incluido el esteroide tetrahidrogestrinona ( THG ), los atletas pueden optar por incorporar tecnologías genéticas riesgosas en sus regímenes de entrenamiento. [3]
La perspectiva dominante es que el dopaje genético es peligroso y poco ético, como lo es cualquier aplicación de una intervención terapéutica con fines no terapéuticos o de mejora, y que compromete la base ética de la medicina y el espíritu del deporte. [4] [35] [36] [7] [37] Otros, que apoyan la mejora humana por motivos más amplios, [38] o que ven una falsa dicotomía entre "natural" y "artificial" o una negación del papel de la tecnología para mejorar el rendimiento deportivo, no se opongan ni apoyen el dopaje genético. [39]
la atribución contiene texto de Mejora genética humana a las 17:03 del 26 de octubre de 2020