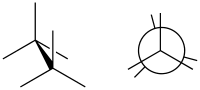

En química, una conformación eclipsada es una conformación en la que dos sustituyentes X e Y en átomos adyacentes A, B están en proximidad más cercana, lo que implica que el ángulo de torsión X–A–B–Y es 0°. [1] Tal conformación puede existir en cualquier cadena abierta, enlace químico simple que conecta dos átomos hibridados sp3 , y normalmente es un máximo de energía conformacional. Este máximo a menudo se explica por el impedimento estérico , pero sus orígenes a veces en realidad se encuentran en la hiperconjugación (como cuando la interacción eclipsante es de dos átomos de hidrógeno).
En el ejemplo del etano, dos grupos metilo están conectados con un enlace sigma carbono-carbono , de la misma manera que uno podría conectar dos piezas de Lego a través de un único "perno" y "tubo". Con esta imagen en mente, si los grupos metilo se rotan alrededor del enlace, permanecerán conectados; sin embargo, la forma cambiará. Esto conduce a múltiples posibles disposiciones tridimensionales, conocidas como conformaciones, isómeros conformacionales (confórmeros) o, a veces, isómeros rotacionales (rotámeros). [2]
Las conformaciones se pueden describir mediante ángulos diedros , que se utilizan para determinar la ubicación de los átomos y su distancia entre sí y se pueden visualizar mediante proyecciones de Newman . Un ángulo diedro puede indicar una orientación escalonada y eclipsada, pero se utiliza específicamente para determinar el ángulo entre dos átomos específicos en carbonos opuestos. Las diferentes conformaciones tienen energías desiguales, lo que crea una barrera energética para la rotación del enlace que se conoce como tensión torsional . En particular, las conformaciones eclipsadas tienden a tener energías elevadas debido a la repulsión de las nubes de electrones de los sustituyentes eclipsados.

Las energías relativas de las diferentes conformaciones se pueden visualizar mediante gráficos. En el ejemplo del etano , dicho gráfico muestra que la rotación alrededor del enlace carbono-carbono no es completamente libre, sino que existe una barrera de energía. Se dice que la molécula de etano en la conformación eclipsada sufre tensión torsional y, mediante una rotación alrededor del enlace carbono-carbono hasta la conformación escalonada, se liberan alrededor de 12,5 kJ/mol de energía torsional .

En el caso del butano y su cadena de cuatro carbonos, hay tres enlaces carbono-carbono disponibles para rotar. El ejemplo siguiente muestra el enlace C2 y C3 en sentido descendente. A continuación se muestra la representación de butano en caballete y Newman en una conformación eclipsada con los dos grupos CH3 ( C1 y C4) en un ángulo de 0 grados entre sí (izquierda).
Si la parte frontal se gira 60° en el sentido de las agujas del reloj, la molécula de butano se encuentra ahora en una conformación escalonada (derecha). Esta conformación se denomina más específicamente conformación gauche del butano. Esto se debe al hecho de que los grupos metilo están escalonados, pero solo a 60° entre sí. Esta conformación es más favorecida energéticamente que la conformación eclipsada, pero no es la conformación más favorable energéticamente. Otra rotación de 60° nos da una segunda conformación eclipsada donde ambos grupos metilo están alineados con átomos de hidrógeno. Una rotación más de 60° produce otra conformación escalonada denominada conformación anti . Esto ocurre cuando los grupos metilo están posicionados opuestos (180°) entre sí. Esta es la conformación más favorable energéticamente. [3]
Los mínimos se pueden ver en el gráfico a 60, 180 y 300 grados, mientras que los máximos se pueden ver a 0, 120, 240 y 360 grados. Los máximos representan las conformaciones eclipsadas debido al ángulo diedro de cero grados. [4]
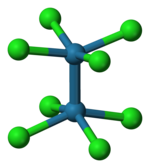
Como se ha establecido mediante cristalografía de rayos X , el anión octaclorodimolibdato(II) ([Mo 2 Cl 8 ] 4- ) tiene una conformación eclipsada. Esta geometría estéricamente desfavorable se presenta como evidencia de un enlace cuádruple entre los centros de Mo. [5]
Experimentos como los análisis de difracción de rayos X y electrones , la resonancia magnética nuclear , las espectroscopias de microondas y más han permitido a los investigadores determinar qué estructuras de cicloalcano son las más estables en función de las diferentes conformaciones posibles. Otro método que demostró ser exitoso es la mecánica molecular , un método computacional que permite encontrar y analizar las energías de deformación total de diferentes conformaciones. Se encontró que las conformaciones más estables tenían energías más bajas en función de los valores de energía debido a las distancias de enlace y los ángulos de enlace. [6]
En muchos casos, los isómeros de alcanos con cadenas ramificadas tienen puntos de ebullición más bajos que los que no están ramificados, lo que se ha demostrado a través de la experimentación con isómeros de C 8 H 18 . Esto se debe a una combinación de fuerzas intermoleculares y tamaño que resulta de las cadenas ramificadas. Cuantas más ramificaciones tenga un alcano, más extendida será su forma; mientras tanto, si está menos ramificado, tendrá más fuerzas de atracción intermoleculares que será necesario romper, lo que es la causa del aumento del punto de ebullición de los alcanos no ramificados. En otro caso, el 2,2,3,3-tetrametilbutano tiene una forma más parecida a un elipsoide, lo que hace que pueda formar una red cristalina que eleva el punto de fusión de la molécula porque se necesitará más energía para pasar de un estado sólido a un estado líquido. [6]