
Dictyostelium discoideum es una especie de ameba que habita en el suelo y pertenece al filo Amoebozoa , infrafilo Mycetozoa . Comúnmente conocida como moho mucilaginoso , D. discoideum es un eucariota que pasa de ser una colección de amebas unicelulares a una babosa multicelular y luego a un cuerpo fructífero durante su vida. Su ciclo de vida asexual único consta de cuatro etapas: vegetativa, agregación, migración y culminación. El ciclo de vida de D. discoideum es relativamente corto, lo que permite la visualización oportuna de todas las etapas. Las células involucradas en el ciclo de vida experimentan movimiento, señalización química y desarrollo, que son aplicables a la investigación del cáncer humano. La simplicidad de su ciclo de vida hace de D. discoideum un organismo modelo valioso para estudiar procesos genéticos, celulares y bioquímicos en otros organismos. [2]
En la naturaleza, D. discoideum se puede encontrar en el suelo y en la hojarasca húmeda. Su dieta principal consiste en bacterias , como Escherichia coli , que se encuentran en el suelo y en materia orgánica en descomposición. Las amebas uninucleadas de D. discoideum consumen bacterias que se encuentran en su hábitat natural, que incluye el suelo de los bosques caducifolios y las hojas en descomposición. [3]
El ciclo de vida de D. discoideum comienza cuando se liberan las esporas de un sorocarpio maduro (cuerpo fructífero). Las mixamoebas nacen de las esporas en condiciones cálidas y húmedas. Durante su etapa vegetativa, las mixamoebas se dividen por mitosis mientras se alimentan de bacterias. Las bacterias secretan ácido fólico , que atrae a las mixamoebas. Cuando se agota el suministro de bacterias, las mixamoebas entran en la etapa de agregación.
Durante la agregación, la inanición inicia la producción de compuestos proteicos como las glicoproteínas y la adenilil ciclasa . [4] Las glicoproteínas permiten la adhesión entre células y la adenilil ciclasa crea AMP cíclico . Las amebas secretan AMP cíclico para atraer a las células vecinas a una ubicación central. A medida que se mueven hacia la señal, chocan entre sí y se adhieren mediante el uso de moléculas de adhesión de glicoproteínas.
La etapa de migración comienza una vez que las amebas han formado un agregado compacto y el montículo alargado de células se inclina para quedar plano en el suelo. Las amebas trabajan juntas como un pseudoplasmodio móvil, también conocido como babosa. La babosa mide alrededor de 2 a 4 mm de largo, está compuesta por hasta 100 000 células [5] y es capaz de moverse al producir una vaina de celulosa en sus células anteriores a través de las cuales se mueve la babosa [6] . Parte de esta vaina queda atrás como un rastro viscoso a medida que se mueve hacia atrayentes como la luz , el calor y la humedad en una dirección solo hacia adelante [6] . El AMP cíclico y una sustancia llamada factor inductor de diferenciación ayudan a formar diferentes tipos de células [6] La babosa se diferencia en células preesporales y presporales que se mueven hacia los extremos anterior y posterior, respectivamente. Una vez que la babosa ha encontrado un ambiente adecuado, el extremo anterior de la babosa forma el tallo del cuerpo fructífero y el extremo posterior forma las esporas del cuerpo fructífero. [6] Las células similares a las anteriores, que se han descubierto recientemente, también se dispersan por toda la región posterior de la babosa. Estas células similares a las anteriores forman la parte inferior del cuerpo fructífero y las tapas de las esporas. [6] Después de que la babosa se asienta en un lugar, el extremo posterior se extiende con el extremo anterior elevado en el aire, formando lo que se llama el "sombrero mexicano", y comienza la etapa de culminación.
Las células pre-esporas y las células pre-esporas cambian de posición en la etapa de culminación para formar el cuerpo fructífero maduro. [6] El extremo anterior del sombrero mexicano forma un tubo de celulosa, que permite que las células más posteriores se desplacen hacia arriba por el exterior del tubo hasta la parte superior, y las células pre-esporas se desplacen hacia abajo. [6] Este reordenamiento forma el tallo del cuerpo fructífero formado por las células del extremo anterior de la babosa, y las células del extremo posterior de la babosa están en la parte superior y ahora forman las esporas del cuerpo fructífero. Al final de este proceso de 8 a 10 horas, el cuerpo fructífero maduro está completamente formado. [6] Este cuerpo fructífero mide 1-2 mm de alto y ahora puede comenzar todo el ciclo nuevamente liberando las esporas maduras que se convierten en mixamoebas.
Aunque D. discoideum generalmente se reproduce asexualmente , D. discoideum aún es capaz de reproducirse sexualmente si se cumplen ciertas condiciones. D. discoideum tiene tres tipos de apareamiento diferentes y los estudios han identificado el locus sexual que especifica estos tres tipos de apareamiento. Las cepas de tipo I están especificadas por el gen llamado MatA, las cepas de tipo II tienen tres genes diferentes: MatB (homólogo a Mat A), Mat C y Mat D, y las cepas de tipo III tienen genes Mat S y Mat T (que son homólogos a Mat C y Mat D). [7] Estos sexos solo pueden aparearse con los dos sexos diferentes y no con el suyo propio. [7]
Cuando se incuban con su suministro de alimento bacteriano, puede ocurrir un desarrollo sexual heterotálico u homotálico , lo que resulta en la formación de un cigoto diploide. [8] [9] El apareamiento heterotálico ocurre cuando dos amebas de diferentes tipos de apareamiento están presentes en un ambiente oscuro y húmedo, donde pueden fusionarse durante la agregación para formar una célula cigoto gigante. La célula gigante luego libera AMPc para atraer otras células, luego envuelve a las otras células de manera caníbal en el agregado. Las células consumidas sirven para encerrar todo el agregado en una pared gruesa de celulosa para protegerlo. Esto se conoce como macroquiste . Dentro del macroquiste, la célula gigante se divide primero a través de la meiosis , luego a través de la mitosis para producir muchas amebas haploides que serán liberadas para alimentarse como lo harían las amebas normales. Las cepas homotálicas AC4 y ZA3A de D. discoideum también pueden producir macroquistes. [10] Cada una de estas cepas, a diferencia de las cepas heterotálicas, probablemente expresa ambos alelos de tipo de apareamiento ( matA y mata ). Si bien la reproducción sexual es posible, es muy raro ver una germinación exitosa de un macroquiste de D. discoideum en condiciones de laboratorio. Sin embargo, la recombinación está muy extendida dentro de las poblaciones naturales de D. discoideum , lo que indica que es probable que el sexo sea un aspecto importante de su ciclo de vida. [9]
Debido a que muchos de sus genes son homólogos a los genes humanos, pero su ciclo de vida es simple, D. discoideum se utiliza comúnmente como un organismo modelo . Se puede observar a niveles organísmicos, celulares y moleculares principalmente debido a su número restringido de tipos de células y comportamientos, y su rápido crecimiento. [6] Se utiliza para estudiar la diferenciación celular, la quimiotaxis y la apoptosis , que son todos procesos celulares normales. También se utiliza para estudiar otros aspectos del desarrollo, incluida la clasificación celular, la formación de patrones, la fagocitosis, la motilidad y la transducción de señales. [11] Estos procesos y aspectos del desarrollo están ausentes o son demasiado difíciles de ver en otros organismos modelo. D. discoideum está estrechamente relacionado con los metazoos superiores. Lleva genes y vías similares, lo que lo convierte en un buen candidato para la eliminación de genes . [12]
El proceso de diferenciación celular ocurre cuando una célula se especializa más para convertirse en un organismo multicelular. Los cambios en el tamaño, la forma, las actividades metabólicas y la capacidad de respuesta pueden ocurrir como resultado de los ajustes en la expresión genética. La diversidad y diferenciación celular, en esta especie, implica decisiones tomadas a partir de interacciones entre células en vías hacia células madre o células esporuladas. [13] Estos destinos celulares dependen de su entorno y de la formación de patrones. Por lo tanto, el organismo es un excelente modelo para estudiar la diferenciación celular.
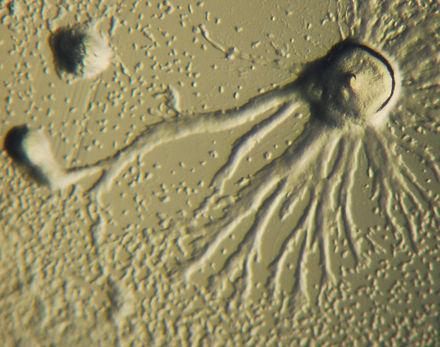
La quimiotaxis se define como el paso de un organismo hacia o desde un estímulo químico a lo largo de un gradiente de concentración química. Ciertos organismos demuestran quimiotaxis cuando se mueven hacia un suministro de nutrientes. En D. discoideum , la ameba secreta la señal, cAMP, fuera de la célula, atrayendo a otras amebas para migrar hacia la fuente. Cada ameba se mueve hacia una ameba central, la que dispensa la mayor cantidad de secreciones de cAMP. La secreción de cAMP es exhibida entonces por todas las amebas y es un llamado para que comiencen la agregación. Estas emisiones químicas y el movimiento de la ameba ocurren cada seis minutos. Las amebas se mueven hacia el gradiente de concentración durante 60 segundos y se detienen hasta que se envía la siguiente secreción. Este comportamiento de las células individuales tiende a causar oscilaciones en un grupo de células, y las ondas químicas de concentración variable de cAMP se propagan a través del grupo en espirales. [14] : 174–175
Los biólogos matemáticos Thomas Höfer y Martin Boerlijst descubrieron un elegante conjunto de ecuaciones matemáticas que reproducen las espirales y los patrones de movimiento de D. discoideum . El biólogo matemático Cornelis J. Weijer ha demostrado que ecuaciones similares pueden modelar su movimiento. Las ecuaciones de estos patrones están influenciadas principalmente por la densidad de la población de amebas, la tasa de producción de AMP cíclico y la sensibilidad de las amebas individuales al AMP cíclico. El patrón en espiral lo forman las amebas en el centro de una colonia que giran mientras envían ondas de AMP cíclico. [15] [16]
El uso de AMPc como agente quimiotáctico no se ha establecido en ningún otro organismo. En biología del desarrollo, este es uno de los ejemplos comprensibles de quimiotaxis, que es importante para comprender la inflamación, la artritis, el asma, el tráfico de linfocitos y la guía axonal en humanos. La fagocitosis se utiliza en la vigilancia inmunitaria y la presentación de antígenos, mientras que la determinación del tipo celular, la clasificación celular y la formación de patrones son características básicas de la embriogénesis que pueden estudiarse con estos organismos. [6]
Sin embargo, cabe señalar que las oscilaciones de AMPc pueden no ser necesarias para la migración celular colectiva en etapas multicelulares. Un estudio ha descubierto que la señalización mediada por AMPc cambia de ondas que se propagan a un estado estable en una etapa multicelular de D. discoideum. [17]
La termotaxis es el movimiento a lo largo de un gradiente de temperatura. Se ha demostrado que las babosas migran a lo largo de gradientes extremadamente bajos de solo 0,05 °C/cm, pero la dirección elegida es complicada; parece ser que se alejan de una temperatura unos 2 °C por debajo de la temperatura a la que se habían aclimatado. Este comportamiento complicado se ha analizado mediante modelos informáticos del comportamiento y del patrón periódico de cambios de temperatura en el suelo causados por los cambios diarios en la temperatura del aire. La conclusión es que el comportamiento mueve a las babosas unos pocos centímetros por debajo de la superficie del suelo hasta la superficie. Se trata de un comportamiento sorprendentemente sofisticado por parte de un organismo primitivo sin aparente sentido de la gravedad. [14] : 108–109
La apoptosis (muerte celular programada) es una parte normal del desarrollo de las especies. [4] La apoptosis es necesaria para el espaciamiento y la escultura adecuados de órganos complejos. Alrededor del 20% de las células de D. discoideum se sacrifican altruistamente en la formación del cuerpo fructífero maduro. Durante la etapa de pseudoplasmodium (babosa o grex) de su ciclo de vida, el organismo ha formado tres tipos principales de células: células pre-tallo, presporales y de tipo anterior. Durante la culminación, las células pre-tallo secretan una capa de celulosa y se extienden como un tubo a través del grex. [4] A medida que se diferencian, forman vacuolas y se agrandan, levantando las células pre-esporales. Las células del tallo experimentan apoptosis y mueren a medida que las células pre-esporales se elevan por encima del sustrato. Las células pre-esporales luego se convierten en células esporales, cada una de las cuales se convierte en una nueva mixamoeba al dispersarse. [6] Este es un ejemplo de cómo se utiliza la apoptosis en la formación de un órgano reproductivo, el cuerpo fructífero maduro.
Una importante contribución reciente de la investigación sobre Dictyostelium ha provenido de nuevas técnicas que permiten visualizar la actividad de genes individuales en células vivas. [18] Esto ha demostrado que la transcripción ocurre en "ráfagas" o "pulsos" ( transcripcional bursting ) en lugar de seguir un comportamiento probabilístico o continuo simple. La transcripción en ráfagas ahora parece estar conservada entre bacterias y humanos. Otra característica notable del organismo es que tiene conjuntos de enzimas reparadoras de ADN que se encuentran en células humanas, que faltan en muchos otros sistemas modelo de metazoos populares. [19] Los defectos en la reparación del ADN conducen a cánceres humanos devastadores, por lo que la capacidad de estudiar las proteínas reparadoras humanas en un modelo simple y manejable resultará invaluable.
La capacidad de este organismo para ser fácilmente aislado y cultivado en el laboratorio [6] [20] se suma a su atractivo como organismo modelo. Si bien D. discoideum se puede cultivar en cultivo líquido, generalmente se cultiva en placas de Petri que contienen agar nutritivo y las superficies se mantienen húmedas. Los cultivos crecen mejor a 22-24 °C (temperatura ambiente). D. discoideum se alimenta principalmente de E. coli , que es adecuada para todas las etapas del ciclo de vida. Cuando el suministro de alimento disminuye, las mixamoebas se agregan para formar pseudoplasmodios. Pronto, la placa está cubierta con varias etapas del ciclo de vida. Revisar la placa a menudo permite observaciones detalladas del desarrollo. Las células se pueden recolectar en cualquier etapa de desarrollo y cultivar rápidamente.
Al cultivar D. discoideum en un laboratorio, es importante tener en cuenta sus respuestas conductuales. Por ejemplo, tiene afinidad hacia la luz, las temperaturas más altas, la humedad alta, las concentraciones iónicas bajas y el lado ácido del gradiente de pH. A menudo se realizan experimentos para ver cómo las manipulaciones de estos parámetros obstaculizan, detienen o aceleran el desarrollo. Las variaciones de estos parámetros pueden alterar la velocidad y la viabilidad del crecimiento del cultivo. Además, los cuerpos fructíferos, al ser esta la etapa más alta del desarrollo, son muy sensibles a las corrientes de aire y a los estímulos físicos. Se desconoce si existe un estímulo involucrado en la liberación de esporas.
El análisis detallado de la expresión de proteínas en Dictyostelium se ha visto obstaculizado por grandes cambios en el perfil de expresión de proteínas entre diferentes etapas de desarrollo y una falta general de anticuerpos disponibles comercialmente para antígenos de Dictyostelium . [21] En 2013, un grupo del Beatson West of Scotland Cancer Centre informó sobre un estándar de visualización de proteínas sin anticuerpos para inmunotransferencia basado en la detección de MCCC1 utilizando conjugados de estreptavidina . [22]
El género bacteriano Legionella incluye las especies que causan la enfermedad del legionario en humanos. D. discoideum también es un huésped para Legionella y es un modelo adecuado para estudiar el proceso de infección. [23] Específicamente, D. discoideum comparte con las células huésped de mamíferos un citoesqueleto similar y procesos celulares relevantes para la infección por Legionella , incluyendo fagocitosis , tráfico de membrana, endocitosis , clasificación de vesículas y quimiotaxis.
Un informe de 2011 en Nature publicó hallazgos que demostraron un "comportamiento agrícola primitivo" en las colonias de D. discoideum . [24] [25] Descrito como una " simbiosis " entre D. discoideum y presas bacterianas, aproximadamente un tercio de las colonias de D. discoideum recolectadas en la naturaleza se dedicaron a la " cría " de las bacterias cuando las bacterias se incluyeron dentro de los cuerpos fructíferos del moho mucilaginoso. [25] La incorporación de las bacterias a los cuerpos fructíferos permite la "siembra" de la fuente de alimento en el lugar de la dispersión de las esporas, lo que es particularmente valioso si la nueva ubicación es baja en recursos alimenticios. [25] Las colonias producidas a partir de las esporas "cultivadoras" generalmente también muestran el mismo comportamiento cuando esporulan. Esta incorporación tiene un costo asociado: las colonias que no consumen todas las bacterias presa producen esporas más pequeñas que no pueden dispersarse tan ampliamente. Además, existe mucho menos beneficio para las esporas que contienen bacterias que aterrizan en una región rica en alimentos. Este equilibrio de los costos y beneficios del comportamiento puede contribuir al hecho de que una minoría de colonias de D. discoideum se dediquen a esta práctica. [24] [25]
Se sabe que D. discoideum se alimenta de bacterias grampositivas y gramnegativas , pero algunas de las bacterias fagocitadas, incluidos algunos patógenos humanos, [26] pueden vivir en las amebas y salir sin matar la célula. No se sabe cuándo entran en la célula, dónde residen y cuándo salen de ella. La investigación aún no es concluyente, pero es posible trazar un ciclo de vida general de D. discoideum adaptado para clones de agricultores para comprender mejor este proceso simbiótico.

En la imagen se pueden observar las diferentes etapas. Primero, en la etapa de inanición, las bacterias están encerradas dentro de D. discoideum , [26] después de entrar en las amebas, en un fagosoma se bloquea la fusión con los lisosomas y estos fagosomas no maduros son rodeados por orgánulos de la célula huésped como mitocondrias, vesículas y una membrana multicapa derivada del retículo endoplasmático rugoso (RER) de las amebas. No se conoce el papel del RER en la infección intracelular, pero el RER no es necesario como fuente de proteínas para las bacterias. [27] Las bacterias residen dentro de estos fagosomas durante las etapas de agregación y desarrollo multicelular. Las amebas conservan su individualidad y cada ameba tiene su propia bacteria. Durante la etapa de culminación, cuando se producen las esporas, las bacterias pasan de la célula al soro con la ayuda de una estructura citoesquelética que evita la destrucción de la célula huésped. [28] Algunos resultados sugieren que las bacterias explotan la exocitosis sin matar a la célula. [28] Las amebas de vida libre parecen desempeñar un papel crucial para la persistencia y dispersión de algunos patógenos en el medio ambiente. Se ha informado de la asociación transitoria con amebas para varias bacterias diferentes, incluidas Legionella pneumophila , muchas especies de Mycobacterium , Francisella tularensis y Escherichia coli , entre otras. [27] La agricultura parece desempeñar un papel crucial para la supervivencia de los patógenos, ya que pueden vivir y replicarse dentro de D. discoideum , lo que facilita la cría. El informe de Nature ha hecho un avance importante en el conocimiento del comportamiento amebiano, y la famosa frase española traducida como "eres más tonto que una ameba" está perdiendo el sentido porque las amebas son un excelente ejemplo de comportamiento social con una coordinación asombrosa y sentido del sacrificio en beneficio de la especie. [ cita requerida ]
Las células centinela de Dictyostelium discoideum son células fagocíticas responsables de eliminar el material tóxico de la etapa de babosa del ciclo social. Estas células, generalmente de forma redonda, están presentes dentro de la vaina de la babosa, donde se encuentran circulando libremente. El proceso de desintoxicación ocurre cuando estas células engullen toxinas y patógenos dentro de la babosa a través de la fagocitosis . Luego, las células se agrupan en grupos de cinco a diez células, que luego se adhieren a la vaina interna de la babosa. La vaina se desprende a medida que la babosa migra a un nuevo sitio en busca de bacterias alimenticias.
Las células centinela constituyen aproximadamente el 1% del número total de células de las babosas, y el número de células centinela permanece constante incluso cuando se liberan. Esto indica una regeneración constante de células centinela dentro de las babosas a medida que se eliminan junto con toxinas y patógenos. Las células centinela están presentes en la babosa incluso cuando no hay toxinas o patógenos que eliminar. Se han localizado células centinela en otras cinco especies de Dictyostelia , lo que sugiere que las células centinela pueden describirse como una característica general del sistema inmunológico innato en las amebas sociales. [29]
El número de células centinela varía según el estado de cultivo de D. discoideum silvestre . Cuando se expuso a un ambiente tóxico creado por el uso de bromuro de etidio, se demostró que el número de células centinela por milímetro era menor para los agricultores que para los no agricultores. Esto se concluyó observando los rastros que dejaban atrás mientras las babosas migraban y contando el número de células centinela presentes en un milímetro. Sin embargo, el número de células centinela no afecta la producción y viabilidad de esporas en los agricultores. Los agricultores expuestos a un entorno tóxico producen la misma cantidad de esporas que los agricultores en un entorno no tóxico, y la viabilidad de las esporas fue la misma entre los agricultores y los no agricultores. Cuando se elimina el clado 2 Burkholderia , o las bacterias asociadas a los agricultores, de los agricultores, la producción y viabilidad de esporas fueron similares a las de los no agricultores. Por lo tanto, se sugiere que las bacterias transportadas por los agricultores brindan una función adicional de protección para los agricultores contra daños potenciales debido a toxinas o patógenos. [30]
En clasificaciones más antiguas, Dictyostelium se ubicaba en la clase polifilética extinta Acrasiomycetes . Esta era una clase de mohos mucilaginosos celulares, que se caracterizaba por la agregación de amebas individuales en un cuerpo fructífero multicelular, lo que lo convertía en un factor importante que relacionaba a los acrásidos con los dictiostélidos. [31]
Estudios genómicos más recientes han demostrado que Dictyostelium ha mantenido más de su diversidad genómica ancestral que las plantas y los animales, aunque la filogenia basada en el proteoma confirma que los amoebozoa divergieron del linaje animal-fúngico después de la división planta-animal. [32] La subclase Dictyosteliidae, orden Dictyosteliales es un ensamblaje monofilético dentro de Mycetozoa, un grupo que incluye los mohos mucilaginosos protostélidos, dictiostélidos y mixogástridos. Los análisis de datos del factor de elongación-1α (EF-1α) respaldan a Mycetozoa como un grupo monofilético, aunque los árboles de ARNr lo ubican como un grupo polifilético. Además, estos datos respaldan la idea de que los dictiostélidos y los mixogástridos están más estrechamente relacionados entre sí que los protostélidos. El análisis de EF-1α también colocó a Mycetozoa como el grupo externo inmediato para el clado animal-fúngico. [33] Los últimos datos filogenéticos sitúan a los dictiostélidos firmemente dentro del supergrupo Amoebozoa , junto con los mixomicetos . Mientras tanto, los protostélidos han resultado ser polifiléticos, y sus cuerpos fructíferos pedunculados son una característica convergente de múltiples linajes no relacionados. [34]
El proyecto de secuenciación del genoma de D. discoideum fue completado y publicado en 2005 por una colaboración internacional de institutos. Este fue el primer genoma de un protozoo de vida libre en ser secuenciado completamente. D. discoideum consiste en un genoma haploide de 34 Mb con una composición de bases del 77% [A+T] y contiene seis cromosomas que codifican alrededor de 12.500 proteínas. [3] La secuenciación del genoma de D. discoideum proporciona un estudio más intrincado de su biología celular y de desarrollo.
Las repeticiones en tándem de trinucleótidos son muy abundantes en este genoma; una clase del genoma está agrupada, lo que lleva a los investigadores a creer que sirve como centrómeros. Las repeticiones corresponden a secuencias repetidas de aminoácidos y se cree que se expanden mediante la expansión de nucleótidos. [3] La expansión de repeticiones de trinucleótidos también ocurre en humanos, en general conduce a muchas enfermedades. Aprender cómo las células de D. discoideum soportan estas repeticiones de aminoácidos puede proporcionar información que permita a los humanos tolerarlas.
Cada genoma secuenciado desempeña un papel importante en la identificación de genes que se han ganado o perdido con el tiempo. Los estudios genómicos comparativos permiten comparar genomas eucariotas. Una filogenia basada en el proteoma mostró que los amebozoos se desviaron del linaje animal-fúngico después de la división planta-animal. [3] El genoma de D. discoideum es notable porque sus muchas proteínas codificadas se encuentran comúnmente en hongos, plantas y animales. [3]
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ){{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )