En química orgánica , el término catión 2-norbornilo (o catión 2-biciclo[2.2.1]heptilo ) describe uno de los tres carbocationes formados a partir de derivados del norbornano . Aunque se han estudiado los cationes 1-norbornilo y 7-norbornilo, los estudios más extensos y los debates más intensos se han centrado en la estructura exacta del catión 2-norbornilo.
El catión 2-norbornilo se ha formado a partir de diversos derivados y reactivos de norbornano. Los primeros informes sobre su formación y reactividad publicados por Saul Winstein provocaron controversia sobre la naturaleza de su enlace , ya que invocó un enlace de tres centros y dos electrones para explicar el resultado estereoquímico de la reacción. Herbert C. Brown cuestionó esta afirmación basándose en que las estructuras de resonancia clásicas podrían explicar estas observaciones sin necesidad de adaptar una nueva perspectiva de la vinculación. Los puntos de vista de ambos investigadores tuvieron sus partidarios, y docenas de científicos contribuyeron con experimentos ingeniosamente diseñados para proporcionar evidencia de un punto de vista u otro. Con el tiempo, la disputa se volvió cada vez más amarga y enconada, y el debate adquirió un carácter personal o ad hominem . [1]
La evidencia de la naturaleza no clásica del catión 2-norbornilo aumentó a lo largo de varias décadas, principalmente a través de datos espectroscópicos recopilados utilizando métodos como la resonancia magnética nuclear (RMN). La confirmación cristalográfica de su naturaleza no clásica no llegó hasta 2013. [2] Aunque la mayoría de los químicos ahora están de acuerdo en que el catión 2-norbornilo en sí no es clásico, también se reconoce ampliamente que el panorama energético de los carbocationes tiende a ser "plano". , con muchas estructuras potenciales que difieren sólo mínimamente en energía. Ciertamente, no todos los carbocationes bicíclicos son no clásicos; La diferencia de energía entre las estructuras clásicas y no clásicas suele estar delicadamente equilibrada. Por lo tanto, ahora se sabe que ciertos cationes 2-biciclo[2.2.1]heptilo sustituidos con alquilo adoptan estructuras clásicas.
La naturaleza del enlace en el catión 2-norbornilo incorporó muchas ideas nuevas a la comprensión de los enlaces químicos en el campo. Se pueden observar similitudes entre este catión y otros, como los boranos .
La naturaleza del enlace en el catión 2-norbornilo fue el centro de un debate vigoroso y bien conocido en la comunidad química hasta mediados del siglo XX. Mientras que la mayoría de los químicos creían que un enlace de tres centros y dos electrones representaba mejor su estructura electrónica del estado fundamental , otros argumentaban que todos los datos relacionados con el catión 2-norbornilo podrían explicarse representándolo como un par de cationes en rápido equilibrio .
En el punto álgido del debate, todos los químicos estuvieron de acuerdo en que la imagen deslocalizada del enlace electrónico podría aplicarse al catión 2-norbornilo. Pero esto no respondió a la pregunta fundamental sobre la que giraba el debate. Los investigadores continuaron buscando formas novedosas de determinar si la imagen deslocalizada de tres centros describía un estado de transición de baja energía (punto de silla en la superficie de energía potencial multidimensional ) o un mínimo de energía potencial en sí mismo. [1] Los defensores de la imagen "clásica" creían que el sistema se describía mejor mediante un potencial de doble pozo con una barrera muy baja, mientras que aquellos en el campo "no clásico" imaginaban el estado electrónico deslocalizado para describir una única energía potencial. Bueno. [3]

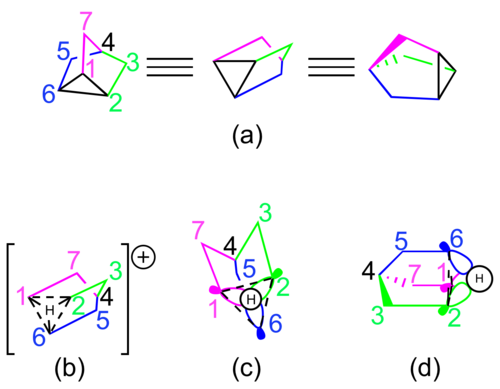
Los defensores de la naturaleza no clásica del catión 2-norbornilo estable suelen representar la especie utilizando estructuras de resonancia o una estructura única con enlaces parciales ( consulte la Figura 2 ). Esta interacción hipovalente se puede imaginar como el efecto neto de i) un enlace sigma parcial entre los carbonos 1 y 6, ii) un enlace sigma parcial entre los carbonos 2 y 6, y iii) un enlace pi parcial entre los carbonos 1 y 2. [4 ] Cada enlace parcial se representa como un enlace completo en una de las tres estructuras de resonancia o como un enlace parcial discontinuo si el catión se representa a través de una sola estructura.

Ha habido cierto debate sobre cuánto contribuye realmente la estructura de resonancia unida pi a la estructura electrónica deslocalizada. [6] A través de espectroscopía de RMN de 1 H y 13 C , se ha confirmado que una carga positiva significativa se encuentra en el carbono 6 de metileno. [7] Esto es sorprendente ya que los carbocationes primarios son mucho menos estables que los carbocationes secundarios. Sin embargo, el catión 2-norbornilo se puede formar a partir de derivados de β-(Δ 3 -ciclopentenil)-etano, lo que indica que la estructura de resonancia por enlace pi es significativa. [8]
El catión 2-norbornilo fue uno de los primeros ejemplos de ión no clásico . Los iones no clásicos se pueden definir como cationes orgánicos en los que la densidad electrónica de un orbital de enlace lleno se comparte en tres o más centros y contiene algún carácter de enlace sigma. [9] El catión 2-norbornilo se considera el prototipo de los iones no clásicos. Otros cationes simples como el acetileno protonado (etinio, C
2h+
3), etileno protonado (etenio, C
2h+
5), y etano protonado (etanio, C
2h+
7) se ha demostrado que se describen mejor como no clásicos mediante espectroscopia infrarroja. [10]
La representación de orbital molecular propuesta con mayor frecuencia para el catión 2-norbornilo se muestra en la Figura 3. Dos orbitales de tipo p , uno en cada uno de los carbonos 1 y 2, interactúan con un orbital hibridado sp 3 en el carbono 6 para formar el enlace hipovalente. . [5] [11] Los cálculos de la teoría ampliada de Hückel para el catión 2-norbornilo sugieren que el orbital del carbono 6 podría tener una hibridación sp 2 , aunque esto sólo afecta a la geometría de los hidrógenos geminales . [12]

Según los defensores del potencial clásico de doble pozo, el catión 2-norbornilo existe en equilibrio dinámico entre dos estructuras enantioméricas asimétricas. La especie deslocalizada central en la imagen no clásica es simplemente un estado de transición entre las dos estructuras. Se invocan los reordenamientos de Wagner-Meerwein como el mecanismo que convierte entre los dos enantiómeros ( ver Figura 4 ).
Los esfuerzos para aislar espectroscópicamente las especies asimétricas suelen fracasar. Se informa que la razón principal de este fracaso son las velocidades de reacción directa e inversa extremadamente rápidas , que indican una barrera potencial muy baja para la interconversión entre los dos enantiómeros. [4]
Algunos químicos también han considerado que el catión 2-norbornilo está mejor representado por el ion nortriciclonio, un nortriciclono protonado simétrico C3 . Esta representación se invocó por primera vez para explicar parcialmente los resultados de un experimento de codificación de isótopos de 14 C. [13] La representación orbital molecular de esta estructura implica una interacción en fase entre los orbitales hibridados sp 2 de los carbonos 1, 2 y 6 y el orbital atómico 1s en un átomo de hidrógeno compartido ( ver Figura 5 ). [14]
Los iones no clásicos se diferencian de los cationes tradicionales en su estructura electrónica : aunque los enlaces químicos suelen representarse como el intercambio de electrones entre dos átomos, los iones no clásicos estables pueden contener tres o más átomos que comparten un solo par de electrones. [9] En 1939, Thomas Nevell y otros intentaron dilucidar el mecanismo para transformar el clorhidrato de canfeno en cloruro de isobornilo . En uno de los mecanismos de reacción propuestos y descritos en el artículo, la carga positiva de un catión intermedio no se asignó a un solo átomo sino a la estructura en su conjunto. [15] Esto fue citado más tarde por los oponentes de la descripción no clásica como la primera vez que se invocó un ion no clásico. [16] Sin embargo, el término "ion no clásico" no apareció explícitamente en la literatura química hasta más de una década después, cuando se usó para etiquetar enlaces deslocalizados en un catión butilo piramidal. [17]
El término ion sinartético también se invocó para describir enlaces deslocalizados en carbocationes estables antes de que el término ion no clásico se generalizara. Los primeros usuarios de este término comentaron la sorprendente similitud entre el enlace en este tipo de cationes y el enlace en borohidruros . [18]
En 1949, Saul Winstein observó que el brosilato de 2- exo -norbornilo ( p -bromobencenosulfonato) y el tosilato de 2- endo -norbornilo ( p -toluenosulfonato) daban una mezcla racémica del mismo producto, acetato de 2- exo -norbornilo , tras la acetólisis ( ver Figura 6 ). Dado que los tosilatos y los brosilatos funcionan igualmente bien como grupos salientes , concluyó que tanto el norbornano sustituido en 2- endo como en el 2- exo deben pasar por un intermediario catiónico común con una reactividad exo dominante. Informó que este intermedio era muy probablemente un catión 2-norbornilo deslocalizado y simétrico. [19] Más tarde se demostró mediante cromatografía en fase de vapor que la cantidad de endoepímero del producto producido era inferior al 0,02%, lo que demuestra la alta estereoselectividad de la reacción. [20]


Cuando un único enantiómero de brosilato de 2- exo -norbornilo se somete a acetólisis, no se observa actividad óptica en el acetato de 2- exo -norbornilo resultante ( consulte la Figura 7 ). [19] Según la descripción no clásica del catión 2-norbornilo, el plano de simetría presente (que atraviesa los carbonos 4, 5 y 6) permite un acceso igual a ambos enantiómeros del producto, lo que da como resultado la mezcla racémica observada .
También se observó que los norbornanos 2- exosustituidos reaccionaban 350 veces más rápido que los endoisómeros correspondientes . La asistencia anquimérica del enlace sigma entre los carbonos 1 y 6 se racionalizó como explicación de este efecto cinético. [19] Es importante destacar que la ayuda anquimérica invocada llevó a muchos químicos a postular que la estabilidad energética del catión 2-norbornilo se debía directamente a la estructura simétrica en puente invocada en la explicación no clásica. Sin embargo, algunos otros autores ofrecieron explicaciones alternativas para la alta estabilidad sin invocar una estructura no clásica. [1]
En 1951, se sugirió por primera vez que el catión 2-norbornilo en realidad podría describirse mejor si se lo veía como un ion nortriciclonio. [13] Se ha demostrado que el producto principal formado a partir de una reacción de eliminación del catión 2-norbornilo es nortricicleno (no norborneno), pero se ha afirmado que esto respalda ambos postulados de iones no clásicos. [20]
Herbert C. Brown no creía que fuera necesario invocar un nuevo tipo de enlace en intermedios estables para explicar la interesante reactividad del catión 2-norbornilo. Al criticar a muchos químicos por ignorar las explicaciones pasadas sobre la reactividad, Brown argumentó que toda la información antes mencionada sobre el catión 2-norbornilo podría explicarse utilizando efectos estéricos simples presentes en el sistema norbornilo. [4] Dado que una explicación alternativa que utilizaba un par de iones que se equilibraban rápidamente para describir el catión 2-norbornilo era válida, no vio la necesidad de invocar una descripción estable y no clásica del enlace. [21] Invocar iones estables no clásicos se estaba convirtiendo en algo común; Brown consideró que esto no sólo era injustificado sino también contraproducente para el campo de la química en su conjunto. De hecho, muchos artículos que informaban sobre iones no clásicos estables fueron posteriormente retractados por ser poco realistas o incorrectos. [3] Después de publicar este controvertido punto de vista en 1962, Brown comenzó una búsqueda para encontrar evidencia experimental incompatible con la imagen deslocalizada del enlace en el catión 2-norbornilo. [22]
Brown también trabajó para demostrar la inestabilidad de una estructura electrónica deslocalizada para el catión 2-norbornilo. Si se pudiera demostrar que el ion no clásico tiene mayor energía que el par de iones clásicos correspondiente, el ion no clásico solo se consideraría como un estado de transición entre los dos cationes asimétricos. [3] [23] Aunque no descartó la posibilidad de un estado de transición deslocalizado, Brown continuó rechazando la simetría reflexiva propuesta del catión 2-norbornilo, incluso al final de su carrera. [24]
La introducción del enlace deslocalizado de dos electrones y tres centros invocado en la imagen no clásica del catión 2-norbornilo permitió a los químicos explorar un ámbito completamente nuevo de enlaces químicos. Los químicos estaban ansiosos por aplicar las características de los estados electrónicos hipovalentes tanto a sistemas nuevos como a viejos (aunque varios se dejaron llevar demasiado). [6] Uno de los conceptos más importantes que surgió de la intensa investigación centrada en los iones no clásicos fue la idea de que los electrones que ya estaban involucrados en enlaces sigma podrían estar involucrados con la reactividad. Aunque se sabía que los orbitales pi llenos eran donantes de electrones , los químicos habían dudado de que los orbitales sigma pudieran funcionar con la misma capacidad. La descripción no clásica del catión 2-norbornilo puede verse como la donación de un par de electrones de un enlace sigma carbono-carbono a un orbital p vacío del carbono 2. Así, este carbocatión demostró que la donación de electrones del enlace sigma es como plausible como donación de electrones por enlace pi. [25] [26]
El intenso debate que siguió al desafío de Brown a los defensores de los iones no clásicos también tuvo un gran impacto en el campo de la química. Para probar o refutar la naturaleza no clásica del catión 2-norbornilo, los químicos de ambos lados del debate buscaron celosamente nuevas técnicas de caracterización química e interpretaciones más innovadoras de los datos existentes. [27] Una técnica espectroscópica que se desarrolló aún más para investigar el catión 2-norbornilo fue la espectroscopia de resonancia magnética nuclear de compuestos en medios altamente ácidos. [1] A menudo se hacían comparaciones del catión 2-norbornilo con estados de transición inestables con estados electrónicos deslocalizados cuando se intentaba dilucidar si el sistema norbornilo era estable o no. Estos esfuerzos motivaron investigaciones más detalladas de los estados de transición y aumentaron enormemente la comprensión de la comunidad científica sobre su estructura electrónica. [27] En resumen, la competencia vigorosa entre grupos científicos condujo a una investigación extensa y a una mejor comprensión de los conceptos químicos subyacentes.
El catión 2-norbornilo se puede producir mediante multitud de rutas sintéticas. Estas rutas se pueden agrupar en tres clases diferentes: Formación σ , Formación π y Formación por Reordenamiento . Cada uno de estos se analiza por separado a continuación.

El material de partida para esta ruta es un derivado de norbornano con un buen grupo saliente en la posición 2. Si el grupo saliente está en la cara exo , la densidad electrónica del enlace σ entre los carbonos 1 y 6 se dona al antienlace σ* entre el carbono. 2 y el grupo saliente ( ver Figura 8b ). [28]
Si el grupo saliente está en la cara endo , el grupo saliente primero se marcha solo. Luego, la densidad electrónica del enlace σ entre los carbonos 1 y 6 se dona al orbital atómico vacío resultante en el carbono 2. Sin embargo, esta ruta de formación es mucho más lenta que la del exoisómero porque el enlace σ no puede proporcionar asistencia anquimérica para el primer paso, haciendo que la energía de activación al primer estado de transición sea mucho mayor. Además, si hay una alta concentración de electrófilos reactivos en la mezcla de reacción, la formación de un derivado de norbornano recién sustituido puede impedir la formación de iones no clásicos. [19] [29]
Un ejemplo de esta ruta de formación es la reacción que llevó a Winstein y Trifan a proponer la estructura deslocalizada del catión 2-norbornilo. Los tosilatos y brosilatos de 2-norbornilo forman el catión 2-norbornilo a través de esta ruta como intermedio hacia la solvólisis . [19]
El material de partida para esta ruta es un derivado de β-(Δ 3 -ciclopentenil)-etano con un buen grupo saliente en el carbono terminal del grupo etano. La densidad electrónica del enlace π del resto alqueno se dona al antienlace σ* entre el carbono terminal y el grupo saliente ( consulte la Figura 8c ). [28] [29]
Por ejemplo, el producto principal de la acetolisis del nosilato de β-(Δ 3 -ciclopentenil)-etilo ( p -nitrobencenosulfonato) es el acetato de 2- exo -norbornilo. La escasez de acetato de β-(Δ 3 -ciclopentenil)-etilo presente después de la reacción se explica por la mayor estabilidad del sistema norbornilo frente al sistema ciclopentenilo decorado. [8]
Esta ruta sólo es eficaz si la ciclopentenilolefina se aísla de cualquier sistema con enlaces π más grande. La velocidad de reacción disminuye significativamente si el doble enlace involucrado forma un anillo aromático de seis miembros, como ocurre en el nosilato de 2-indaniletilo. Se ha observado que las sustituciones de alquilo en las olefinas aumentan la velocidad de reacción al estabilizar el carbocatión resultante. [30]
El catión 2-norbornilo también se puede formar mediante reordenamientos de iones similares, como los cationes 1-norbornilo y 7-norbornilo, aunque generalmente no se comprenden tan bien. Los experimentos de marcaje de isótopos radiactivos de carbono-14 han demostrado que la codificación compleja en los sistemas de cationes norbornilo permite que 14 C esté presente en las siete posiciones del sistema norbornilo. [13] Al realizar ciclos entre temperaturas bajas y altas durante las hidrólisis de 1 y 7-cloronorbornanos, se observó una gran cantidad de 2-norbornanol además de los 1 y 7-norbornanoles esperados, respectivamente. Por tanto, los cationes 1- y 7-norbornilo tienen algún mecanismo mediante el cual pueden reorganizarse en el catión 2-norbornilo, más estable, en la escala de tiempo de las reacciones de solvólisis. [31]
Una sonda para comprobar si el catión 2-norbornilo es no clásico es investigar la simetría inherente del catión. Muchas herramientas espectroscópicas, como la espectroscopia de resonancia magnética nuclear (espectroscopia de RMN) y la espectroscopia Raman , dan pistas sobre la simetría reflexiva y rotacional presente en una molécula o ion. Cada una de las tres estructuras propuestas del catión 2-norbornilo ilustra una simetría molecular diferente. La forma no clásica contiene un plano de reflexión que pasa por los carbonos 4, 5, 6 y el punto medio de los carbonos 1 y 2. La forma clásica no contiene simetría de reflexión ni de rotación. La estructura del nortriciclono protonado contiene un eje de rotación simétrico C 3 a través del carbono 4.
Cada pico en un espectro de RMN corresponde a un conjunto de átomos de un elemento particular que se encuentran en ambientes químicos similares. El espectro de RMN de la sal de cloropentafluoruro de antimonio del catión 2-norbornilo no es útil a temperatura ambiente porque los cambios de hidruro ocurren más rápido que la escala de tiempo de un experimento de RMN; Por tanto, la mayoría de los hidrógenos se consideran equivalentes y se contabilizan en el mismo pico de absorción. Al reducir la temperatura del experimento de RMN a -60 °C, los cambios de hidruro se "congelan" y se puede obtener más información estructural del espectro. Los investigadores descubrieron que a estas bajas temperaturas, el espectro de 1 H NMR coincidía con lo que se esperaría de la estructura no clásica del ion. [31] [32]
Los estudios de RMN de 1 H y 13 C pudieron confirmar que cualquier reordenamiento propuesto por Wagner-Meerwein se produjo más rápido que la escala de tiempo del experimento de RMN, incluso a bajas temperaturas. [33] Para moléculas en equilibrio estático con respecto a los reordenamientos, la RMN revela cuántos conjuntos de núcleos relacionados con la simetría hay en la molécula y cuántos núcleos representa cada uno de estos conjuntos mediante la integración del espectro. Para moléculas en equilibrio dinámico, como el catión 2-norbornilo, los núcleos dentro de cada conjunto también pueden transformarse entre sí mediante reordenamientos con velocidades de reacción rápidas. [34] Dado que el equilibrio dinámico propuesto por los defensores de los iones clásicos tenía tasas de reordenamiento muy rápidas, los primeros estudios de RMN no favorecieron ni invalidaron ninguna de las tres estructuras propuestas. [7] Pero al utilizar el análisis de RMN de estado sólido , se puede reducir la temperatura del experimento de RMN a 5 kelvins (-268 °C) y, por lo tanto, ralentizar significativamente cualquier fenómeno de reordenamiento. Los espectros de RMN de 13 C en estado sólido del catión 2-norbornilo muestran que los carbonos 1 y 2 se encuentran en entornos químicos idénticos, lo que sólo concuerda con la imagen no clásica del catión 2-norbornilo. [35]
Los espectros Raman del catión 2-norbornilo muestran una especie más simétrica de lo que se esperaría para un par de iones clásicos en rápido equilibrio. Dado que las velocidades de reacción propuestas para los reordenamientos iónicos clásicos son más lentas que la escala de tiempo Raman, se esperaría que los espectros Raman indicaran una especie menos simétrica si la imagen clásica fuera correcta. [6]
Algunos estudios de 13 C NMR en particular favorecieron la interpretación a través de la estructura del nortriciclono protonado. [36] Además, los espectros Raman del catión 2-norbornilo en algunos disolventes ácidos muestran una banda de absorción a 3110 cm -1 indicativa de un anillo de ciclopropano empobrecido en electrones. Dado que esa banda de absorción se esperaría en el nortriciclono protonado simétrico C 3 , algunos científicos afirmaron que esto era una evidencia convincente para esta interpretación. [37] Otros químicos han postulado que las propiedades del catión 2-norbornilo dependen mucho del entorno disolvente. Aunque la alta acidez y la baja nucleofilia de los disolventes utilizados en los experimentos antes mencionados pueden hacer que la geometría del nortricilconio protonado sea la más estable, esta geometría no tiene por qué ser la más favorable energéticamente en otros disolventes. [6]
Se han utilizado muchos estudios de cálculo para comparar la viabilidad de diferentes geometrías propuestas. Utilizando el método cuántico semiempírico de MINDO/3 , los investigadores no pudieron concluir qué geometría del catión 2-norbornilo era energéticamente más favorable. Sin embargo, se descubrió que la estructura clásica era el único mínimo potencial para el catión 2-metil-2-norbornilo sustituido con alquilo. [38] Se encontró que cálculos adicionales utilizando la teoría de Hückel extendida para orbitales moleculares favorecen la geometría no clásica del catión con simetría reflexiva. [12] [39]
Algunos estudios han utilizado comparaciones interesantes para probar la estabilidad energética del catión 2-norbornilo proporcionada por su naturaleza deslocalizada. Comparando el reordenamiento entre el catión 3-metil-2-norbornilo y el catión 2-metil-2-norbornilo con el de los carbocationes de isopentano terciario y secundario , se encuentra que el cambio en entalpía es aproximadamente 6 kcal/mol menos para el catión norbornilo. sistema. Dado que la principal diferencia entre estos dos reordenamientos reversibles es la cantidad de deslocalización posible en el estado fundamental electrónico, se puede atribuir la estabilización del catión 3-metil-2-norbornilo a su naturaleza no clásica. [40] Sin embargo, algunos estudios experimentales no lograron observar esta estabilización en las reacciones de solvólisis. [3]
Otros estudios sobre la estabilidad del catión 2-norbornilo han demostrado que las sustituciones de alquilo en los carbonos 1 o 2 obligan al sistema a ser decididamente clásico. Los carbocationes terciarios son mucho más estables que sus homólogos secundarios y, por lo tanto, no necesitan adoptar enlaces deslocalizados para alcanzar la energía potencial más baja posible. [41] [42]
Para respaldar su sugerencia de la naturaleza no clásica del catión 2-norbornilo, Winstein y Trifan utilizaron por primera vez evidencia cinética del aumento de la velocidad de reacción para la formación del catión 2- exo -norbornilo sobre el catión 2- endo -norbornilo. [19] Otros investigadores investigaron la velocidad de reacción de compuestos que podrían presentar asistencia anquimérica pero que no podían sufrir reordenamientos ya que el sistema norbornilo podría mostrar tendencias similares en la mejora de la velocidad. Algunos han afirmado que esto es una prueba definitiva de la imagen no clásica. [43] Pero no todos están de acuerdo. Otros investigadores descubrieron que los derivados de ciclopentano que eran estructuralmente similares al sistema norbornilo todavía presentaban velocidades de reacción mejoradas, lo que los llevó a afirmar que el catión norbornilo clásico describe el sistema mucho mejor. [44] [45]

Los experimentos de etiquetado de isótopos radiactivos proporcionan una herramienta poderosa para determinar la estructura de las moléculas orgánicas. Al descomponer sistemáticamente el catión 2-norbornilo y analizar la cantidad de isótopo radiactivo en cada producto de descomposición, los investigadores pudieron mostrar más evidencia del cuadro no clásico de enlace deslocalizado ( consulte la Figura 9 ). Los defensores de la visión no clásica esperarían que el 50% del CO 2 generado en la descomposición de la Figura 9 contuviera 14 C, mientras que los defensores de la visión clásica esperarían que una mayor parte del CO 2 generado fuera radiactivo debido a la naturaleza de vida corta del el catión. Se ha observado que el 40% del dióxido de carbono producido por descomposición es radiactivo, lo que sugiere que la imagen no clásica es más correcta. [14]
Es posible realizar una mayor distinción entre las estructuras clásicas y no clásicas del catión 2-norbornilo combinando experimentos de RMN con experimentos de marcaje de isótopos. La sustitución isotópica de uno de los dos átomos de deuterio por un átomo de hidrógeno hace que el entorno de los átomos cercanos activos en RMN cambie drásticamente. El etiquetado (sustitución) de isótopos de deuterio asimétrico hará que un conjunto de carbonos que eran todos equivalentes en las especies totalmente de hidrógeno se divida en dos o más conjuntos de carbonos equivalentes en las especies marcadas con deuterio; esto se manifestará en el espectro de RMN como un pico en el espectro de las especies totalmente de hidrógeno que se convertirá en al menos dos picos "divididos" en las especies deuteromarcadas. Si un sistema está experimentando un equilibrio rápido a un ritmo más rápido que la escala de tiempo de un experimento de RMN de 13 C, el pico relevante se dividirá drásticamente (del orden de 10 a 100 ppm). Si el sistema es estático, el pico se dividirá muy poco. [46] [47] El espectro de RMN de 13 C del catión 2-norbornilo a -150 °C muestra que los picos correspondientes a los carbonos 1 y 2 se dividen en menos de 10 ppm (partes por millón) cuando se lleva a cabo este experimento. , lo que indica que el sistema no está experimentando un equilibrio rápido como en la imagen clásica. [48]
Aunque la caracterización de los cristales del catión 2-norbornilo puede haber impedido significativamente nuevos debates sobre su estructura electrónica, no cristaliza bajo ninguna condición estándar. Recientemente, la estructura cristalina se obtuvo y se informó a través de un medio creativo: la adición de tribromuro de aluminio a bromuro de 2-norbornilo en dibromometano a bajas temperaturas produjo cristales de [ C
7h
11] + [ Al
2hermano
7] − · CH
2hermano
2. [2] Al examinar la estructura cristalina resultante, los investigadores pudieron confirmar que la geometría cristalina respalda mejor el caso del enlace deslocalizado en el catión estable 2-norbornilo. Se encontró que las longitudes de los enlaces entre el carbono 6 "puente" y cada uno de los carbonos 1 y 2 eran ligeramente más largas que los enlaces alcanos típicos. Según la imagen no clásica, uno esperaría un orden de enlace entre 0 y 1 para estos enlaces, lo que significa que esto explica bien la estructura cristalina. Se informó que la longitud del enlace entre los carbonos 1 y 2 se encuentra entre las longitudes típicas de enlaces carbono-carbono simples y dobles, lo que concuerda con predicciones no clásicas de un orden de enlace ligeramente superior a 1. Los investigadores que cristalizaron el catión 2-norbornilo comentaron que el catión resultó imposible. cristalizar a menos que se le proporcione un entorno químico que lo fije en una orientación definida. [2]