El carbono atómico , denominado sistemáticamente carbono y λ 0 -metano , es un compuesto químico inorgánico gaseoso incoloro con la fórmula química C (también escrita [C]). Es cinéticamente inestable a temperatura y presión ambiente, y se elimina mediante autopolimerización.
El carbono atómico es el más simple de los alótropos del carbono y también es el progenitor de los grupos de carbono. Además, puede considerarse el monómero de todos los alótropos de carbono (condensados), como el grafito y el diamante.
El nombre trivial monocarbono es el nombre IUPAC más comúnmente usado y preferido . El nombre sistemático carbono , un nombre IUPAC válido , se construye de acuerdo con la nomenclatura compositiva. Sin embargo, como nombre compositivo, no distingue entre diferentes formas de carbono puro. El nombre sistemático λ 0 -metano , también nombre IUPAC válido, se construye de acuerdo con la nomenclatura sustitutiva. Junto con monocarbono , este nombre distingue al compuesto titular ya que se derivan utilizando información estructural sobre la molécula. Para reflejar mejor su estructura, el carbono atómico libre a menudo se escribe como [C]. λ 2 -metilio ( [CH]+
) es el ion resultante de la ganancia de H+por carbono atómico.
Un ácido de Lewis puede unirse a un par de electrones del carbono atómico, y un par de electrones de una base de Lewis puede unirse al carbono atómico por aducción: [1]
Debido a esta donación o aceptación de un par de electrones aducido, el carbono atómico tiene carácter anfótero de Lewis. [2] El carbono atómico tiene la capacidad de donar hasta dos pares de electrones a ácidos de Lewis, o aceptar hasta dos pares de bases de Lewis.
Un protón puede unirse al carbono atómico mediante protonación:
Debido a esta captura del protón ( H+
), el carbono atómico y sus aductos de bases de Lewis, como el agua, también tienen carácter básico de Brønsted-Lowry. El ácido conjugado del carbono atómico es λ 2 -metilio ( CH+
).
Sin embargo, las soluciones acuosas de aductos son inestables debido a la hidratación del centro de carbono y del grupo λ 2 -metilo para producir λ 2 -metanol (CHOH) o λ 2 -metano ( CH
2), o hidroximetilo ( CH
2OH+
) grupos, respectivamente.
El grupo λ 2 -metanol en los aductos puede potencialmente isomerizarse para formar formaldehído , o hidratarse aún más para formar metanodiol . El grupo hidroximetilio en los aductos puede potencialmente hidratarse aún más para formar dihidroximetilio ( CH(OH)+
2), o ser oxidado por agua para formar formilo ( HCO+
). [1]
Los electrones en el carbono atómico se distribuyen entre los orbitales atómicos de acuerdo con el principio de Aufbau para producir estados cuánticos únicos, con niveles de energía correspondientes. El estado con el nivel de energía más bajo, o estado fundamental, es un estado diradical triplete ( 3 P 0 ), seguido de cerca por 3 P 1 y 3 P 2 . Los siguientes dos estados excitados que están relativamente cerca en energía son un singlete ( 1 D 2 ) y un dirradical singlete ( 1 S 0 ). El estado no radical del carbono atómico se denomina sistemáticamente λ 2 -metilideno, y los estados dirradicales que incluyen el estado fundamental se denominan carbono (2•) o λ 2 -metanodiilo. Los estados 1 D 2 y 1 S 0 se encuentran 121,9 kJ mol −1 y 259,0 kJ mol −1 por encima del estado fundamental, respectivamente. Las transiciones entre estos tres estados están formalmente prohibidas debido al requisito de inversión de espín y/o apareamiento de electrones. Esto significa que el carbono atómico fosforesce en la región del infrarrojo cercano del espectro electromagnético a 981,1 nm. También puede fluorescer en el infrarrojo y fosforescer en la región azul a 873,0 nm y 461,9 nm, respectivamente, tras la excitación con radiación ultravioleta.
Los diferentes estados del carbono atómico presentan comportamientos químicos variables. Por ejemplo, las reacciones del radical triplete con especies no radicales generalmente implican abstracción, mientras que las reacciones del radical singlete no implican solo abstracción, sino también adición por inserción.

Un método de síntesis, desarrollado por Phil Shevlin , que ha realizado el trabajo principal en este campo, consiste en hacer pasar una corriente grande a través de dos barras de carbono adyacentes, generando un arco eléctrico. La forma en que se produce esta especie está estrechamente relacionada con la formación de fulerenos C 60 , siendo la principal diferencia que se utiliza un vacío mucho menor en la formación del carbono atómico.
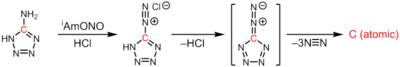
El carbono atómico se genera en la termólisis del 5-diazotetrazol tras la extrusión de 3 equivalentes de dinitrógeno: [3]
CN6 → :C: + 3N2
Se puede obtener una fuente limpia de carbono atómico a partir de la descomposición térmica del carburo de tantalio . En la fuente desarrollada, [4] el carbono se carga en un tubo de tantalio de paredes delgadas . Después de sellarlo, se calienta mediante corriente eléctrica directa . Los átomos de carbono solvatados se difunden hacia la superficie exterior del tubo y, cuando la temperatura aumenta, se observa la evaporación del carbono atómico de la superficie del tubo de tantalio. La fuente proporciona átomos de carbono puro sin presencia de ninguna especie adicional.
El carbono atómico se puede producir mediante la descarbonilación del subóxido de carbono . En este proceso, el subóxido de carbono se descompone para producir carbono atómico y monóxido de carbono según la ecuación:
El proceso implica monóxido de dicarbonato como intermediario y se lleva a cabo en dos pasos. Para ambas descarbonilaciones se necesita radiación ultravioleta lejana fotolítica.
Normalmente, una muestra de carbono atómico existe como una mezcla de estados excitados además del estado fundamental en equilibrio termodinámico. Cada estado contribuye de manera diferente a los mecanismos de reacción que pueden tener lugar. Una prueba sencilla que se utiliza para determinar qué estado está involucrado es hacer uso de la reacción de diagnóstico del estado triplete con O 2 , si el rendimiento de la reacción no cambia, indica que el estado singlete está involucrado. El estado fundamental dirradical normalmente experimenta reacciones de abstracción. El carbono atómico se ha utilizado para generar carbenos "verdaderos" mediante la abstracción de átomos de oxígeno de los grupos carbonilo :
Los carbenos formados de esta manera exhibirán un verdadero comportamiento carbénico. Los carbenos preparados por otros métodos, como los compuestos diazo, podrían exhibir propiedades que se atribuyen mejor al compuesto diazo utilizado para fabricar el carbeno (que imita el comportamiento del carbeno), en lugar de al carbeno en sí. Esto es importante desde una perspectiva mecanicista de comprensión del verdadero comportamiento del carbeno.
Como el carbono atómico es una especie deficiente en electrones, se autopolimeriza espontáneamente en su forma pura o se convierte en un aducto tras el tratamiento con un ácido o base de Lewis. [ ambiguo ] La oxidación del carbono atómico produce monóxido de carbono, mientras que la reducción produce λ 2 -metano. Los no metales , incluido el oxígeno , atacan fuertemente al carbono atómico y forman compuestos de carbono divalente:
El carbono atómico es muy reactivo, la mayoría de las reacciones son muy exotérmicas. Generalmente se llevan a cabo en fase gaseosa a temperaturas de nitrógeno líquido (77 K). Las reacciones típicas con compuestos orgánicos incluyen: [5]
Con la inserción de agua en el enlace OH se forma el carbeno, HC-OH que se reordena en formaldehído, HCHO.