La reacción de Tsuji-Trost (también llamada alquilación alílica de Trost o alquilación alílica ) es una reacción de sustitución catalizada por paladio que involucra un sustrato que contiene un grupo saliente en una posición alílica . El catalizador de paladio primero se coordina con el grupo alilo y luego sufre una adición oxidativa , formando el complejo π -alilo. Este complejo alílico puede luego ser atacado por un nucleófilo , dando como resultado el producto sustituido. [1]

Este trabajo fue iniciado por primera vez por Jirō Tsuji en 1965 [2] y, posteriormente, adaptado por Barry Trost en 1973 con la introducción de ligandos de fosfina . [3] El alcance de esta reacción se ha ampliado a muchos nucleófilos diferentes basados en carbono, nitrógeno y oxígeno, muchos grupos salientes diferentes, muchos ligandos diferentes basados en fósforo, nitrógeno y azufre, y muchos metales diferentes (aunque el paladio todavía es privilegiado). [4] La introducción de ligandos de fosfina condujo a una reactividad mejorada y a numerosas estrategias de alquilación alílica asimétrica. Muchas de estas estrategias están impulsadas por la llegada de ligandos quirales , que a menudo pueden proporcionar una alta enantioselectividad y una alta diastereoselectividad en condiciones suaves. Esta modificación amplía enormemente la utilidad de esta reacción para muchas aplicaciones sintéticas diferentes. La capacidad de formar enlaces carbono-carbono, carbono-nitrógeno y carbono-oxígeno en estas condiciones hace que esta reacción sea muy atractiva tanto para los campos de la química medicinal como para la síntesis de productos naturales.
En 1962, Smidt publicó un trabajo sobre la oxidación de alquenos a grupos carbonilo catalizada por paladio . En este trabajo se determinó que el catalizador de paladio activaba al alqueno para el ataque nucleofílico del hidróxido . [5] Al obtener información de este trabajo, Tsuji planteó la hipótesis de que podría tener lugar una activación similar para formar enlaces carbono-carbono. En 1965, Tsuji publicó un trabajo que confirmaba su hipótesis. Al hacer reaccionar un dímero de cloruro de alilpaladio con la sal sódica del malonato de dietilo , el grupo pudo formar una mezcla de productos monoalquilados y dialquilados . [6]

El alcance de la reacción se amplió sólo gradualmente hasta que Trost descubrió el siguiente gran avance en 1973. Mientras intentaba sintetizar homólogos de sesquiterpenos acíclicos, Trost tuvo problemas con el procedimiento inicial y no pudo alquilar sus sustratos. Estos problemas se superaron con la adición de trifenilfosfina a la mezcla de reacción.

Estas condiciones luego se probaron para otros sustratos y algunas condujeron a "una reacción esencialmente instantánea a temperatura ambiente". Poco después, desarrolló una forma de utilizar estos ligandos para la síntesis asimétrica. [7] No es sorprendente que esto haya estimulado muchas otras investigaciones sobre esta reacción y haya llevado al importante papel que esta reacción desempeña ahora en la química sintética.
Comenzando con una especie de paladio cerovalente y un sustrato que contiene un grupo saliente en posición alílica, la reacción Tsuji-Trost continúa a través del ciclo catalítico que se describe a continuación.

Primero, el paladio se coordina con el alqueno, formando un complejo η 2 π -alil- Pd 0 Π . El siguiente paso es la adición oxidativa en la que el grupo saliente se expulsa con inversión de configuración y se crea un η 3 π -alil- Pd II (también llamado ionización). Luego, el nucleófilo se suma al grupo alilo regenerando el complejo η 2 π -alil-Pd 0 . Al finalizar la reacción, el paladio se desprende del alqueno y puede comenzar nuevamente en el ciclo catalítico . [8]
Los nucleófilos utilizados normalmente se generan a partir de precursores (pronucleófilos) in situ después de su desprotonación con una base. [9] Estos nucleófilos luego se subdividen en nucleófilos "duros" y "blandos" utilizando un paradigma para describir nucleófilos que se basa en gran medida en el pKas de sus ácidos conjugados . Los nucleófilos "duros" suelen tener ácidos conjugados con pKas superiores a 25, mientras que los nucleófilos "blandos" suelen tener ácidos conjugados con pKas inferiores a 25. [10] Este descriptor es importante debido al impacto que estos nucleófilos tienen en la estereoselectividad del producto. Los nucleófilos estabilizados o "blandos" invierten la estereoquímica del complejo π -alilo. Esta inversión junto con la inversión en estereoquímica asociada con la adición oxidativa de paladio produce una retención neta de estereoquímica. Los nucleófilos no estabilizados o "duros", por otro lado, retienen la estereoquímica del complejo π -alilo, lo que resulta en una inversión neta de la estereoquímica. [11]

Esta tendencia se explica examinando los mecanismos del ataque nucleofílico. Los nucleófilos "blandos" atacan el carbono del grupo alilo, mientras que los nucleófilos "duros" atacan el centro metálico, seguido de una eliminación reductiva. [12]
Los ligandos de fosfina, como la trifenilfosfina o el ligando de Trost , se han utilizado para ampliar enormemente el alcance de la reacción de Tsuji-Trost. Estos ligandos pueden modular las propiedades del catalizador de paladio, como el volumen estérico , así como las propiedades electrónicas. Es importante destacar que estos ligandos también pueden infundir quiralidad al producto final, lo que hace posible que estas reacciones se lleven a cabo de forma asimétrica , como se muestra a continuación.
La versión enantioselectiva de la reacción de Tsuji-Trost se llama alquilación alílica asimétrica de Trost (Trost AAA) o simplemente alquilación alílica asimétrica (AAA). Estas reacciones se utilizan a menudo en síntesis asimétrica. [13] [14] [15] La reacción se desarrolló originalmente con un catalizador de paladio soportado por el ligando de Trost , aunque las condiciones adecuadas se han expandido enormemente desde entonces. Se puede impartir enantioselectividad a la reacción durante cualquiera de los pasos además de la descomplejación del paladio del alqueno, ya que el estereocentro ya está establecido en ese punto. Se han conceptualizado cinco formas principales para aprovechar estos pasos y producir condiciones de reacción enantioselectivas. Trost revisó previamente estos métodos de enantiodiscriminación :
El método preferido para la enantiodiscriminación depende en gran medida del sustrato de interés y, en algunos casos, la enantioselectividad puede verse influenciada por varios de estos factores.
Se ha informado que muchos nucleófilos diferentes son eficaces para esta reacción. Algunos de los nucleófilos más comunes incluyen malonatos , enolatos , alcóxidos primarios , carboxilatos , fenóxidos , aminas , azidas , sulfonamidas , imidas y sulfonas .
El alcance de los grupos salientes también se ha ampliado para incluir varios grupos salientes diferentes, aunque los carbonatos , fenoles , fosfatos , haluros y carboxilatos son los más utilizados.
Trabajos recientes han demostrado que el alcance de los nucleófilos "blandos" se puede ampliar para incluir algunos pronucleófilos que tienen pKas mucho más altos que ~ 25. Algunos de estos nucleófilos "blandos" tienen pKas que van hasta 32, [16] e incluso más. Se ha demostrado que los pronucleófilos básicos (~44) actúan como nucleófilos blandos con la adición de ácidos de Lewis que ayudan a facilitar la desprotonación. [17] El rango de pKa mejorado de los nucleófilos "blandos" es fundamental porque estos nucleófilos son los únicos que han sido explorados [18] [19] para reacciones enantioselectivas hasta hace muy poco [20] (aunque las reacciones no enantioselectivas de "duros" Los nucleófilos se conocen desde hace algún tiempo [21] ). Al aumentar el alcance de los pronucleófilos que actúan como nucleófilos "blandos", estos sustratos también se pueden incorporar en reacciones enantioselectivas utilizando métodos previamente informados y bien caracterizados.

Aprovechando la reactividad del ligando trifenilfosfina, la estructura de los ligandos utilizados para la reacción Tsuji-Trost rápidamente se volvió más compleja. Hoy en día, estos ligandos pueden contener fósforo, azufre, nitrógeno o alguna combinación de estos elementos, pero la mayoría de los estudios se han concentrado en los ligandos mono y difosfina. Estos ligandos se pueden clasificar aún más según la naturaleza de su quiralidad, con algunos ligandos que contienen quiralidad central en los átomos de fósforo o carbono, algunos que contienen quiralidad axial biarilo y otros que contienen quiralidad plana . Los ligandos de difosfina con quiralidad central surgieron como un tipo eficaz de ligando (particularmente para procedimientos de alquilación alílica asimétrica), siendo el ligando Trost un ejemplo de ello. [22] Se han empleado ligandos de fosfinooxazolinas (PHOX) en los AAA, particularmente con nucleófilos basados en carbono. [23]
El sustrato de reacción también se ha extendido a los alenos . En esta expansión de anillo específica , la reacción AAA también va acompañada de un reordenamiento de Wagner-Meerwein : [24] [25]
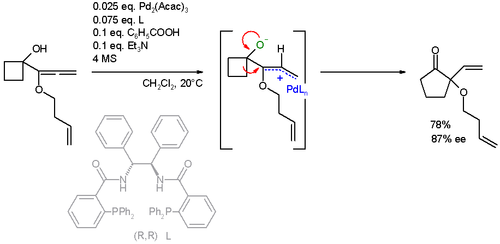
La capacidad de formar enlaces carbono-carbono, carbono-nitrógeno y carbono-oxígeno enantioselectivamente en condiciones suaves hace que la alquilación alílica asimétrica de Trost sea extremadamente atractiva para la síntesis de moléculas complejas.
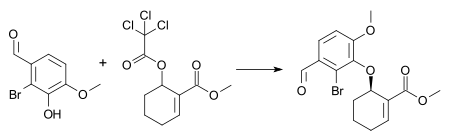
Un ejemplo de esta reacción es la síntesis de un intermedio en la síntesis total combinada de galantamina y morfina [26] con 1% en moles [dímero de cloruro de pi-alilpaladio], 3% en moles ( S,S ) de ligando de Trost y trietilamina en diclorometano. a temperatura ambiente . Estas condiciones dan como resultado la formación del enantiómero (-) del éter arílico con un rendimiento químico del 72% y un exceso enantiomérico del 88% .
Se utilizó otra reacción de Tsuji-Trost durante las etapas iniciales de la síntesis de (-)- neotiobinuparidina . Este trabajo reciente demuestra la capacidad de esta reacción para dar productos altamente diastereoselectivos (10:1) y enantioselectivos (97,5:2,5) a partir de un material de partida aquiral con sólo una pequeña cantidad de catalizador ( 1% ). [27]

Además de la aplicación práctica de esta reacción en química medicinal y síntesis de productos naturales, trabajos recientes también han utilizado la reacción de Tsuji-Trost para detectar paladio en varios sistemas. Este sistema de detección se basa en un sensor no fluorescente derivado de la fluoresceína (recientemente también se han desarrollado sensores de longitud de onda más larga para otras aplicaciones [28] ) que se vuelve fluorescente sólo en presencia de paladio o platino. Esta capacidad de detección de paladio/platino está impulsada por la reacción de Tsuji-Trost. El sensor contiene un grupo alilo y la fluoresceína funciona como grupo saliente. Se forma el complejo π -alilo y, después del ataque de un nucleófilo, se libera la fluoresceína, lo que produce un aumento espectacular de la fluorescencia. [29] [30]

Se ha demostrado que este método simple y de alto rendimiento para detectar paladio mediante el monitoreo de la fluorescencia es útil para monitorear los niveles de paladio en minerales metálicos , [31] productos farmacéuticos , [32] e incluso en células vivas . [33] Con la creciente popularidad de la catálisis de paladio , este tipo de detección rápida debería ser muy útil para reducir la contaminación de productos farmacéuticos y prevenir la contaminación del medio ambiente con paladio y platino.