El ácido malónico es un ácido dicarboxílico con estructura CH2 ( COOH) 2 . La forma ionizada del ácido malónico, así como sus ésteres y sales , se conocen como malonatos . Por ejemplo, el malonato de dietilo es el éster dietílico del ácido malónico . El nombre se origina de la palabra griega μᾶλον ( malon ) que significa 'manzana'.
El ácido malónico [3] es una sustancia natural que se encuentra en muchas frutas y verduras. [4] Se ha sugerido que las frutas cítricas producidas en la agricultura orgánica contienen niveles más altos de ácido malónico que las frutas producidas en la agricultura convencional. [5]
El ácido malónico fue preparado por primera vez en 1858 por el químico francés Victor Dessaignes mediante la oxidación del ácido málico . [3] [6]
La estructura se ha determinado mediante cristalografía de rayos X [7] y se encuentran disponibles datos extensos sobre propiedades, incluida la termoquímica de la fase condensada, en el Instituto Nacional de Estándares y Tecnología . [8] Una preparación clásica de ácido malónico comienza con ácido cloroacético : [9]

El carbonato de sodio genera la sal de sodio , que luego reacciona con cianuro de sodio para proporcionar la sal de sodio del ácido cianoacético a través de una sustitución nucleofílica . El grupo nitrilo se puede hidrolizar con hidróxido de sodio a malonato de sodio, y la acidificación produce ácido malónico. Sin embargo, industrialmente, el ácido malónico se produce por hidrólisis de malonato de dimetilo o malonato de dietilo . [10] También se ha producido a través de la fermentación de glucosa . [11]
El ácido malónico reacciona como un ácido carboxílico típico formando derivados de amida , éster y cloruro . [12] El anhídrido malónico se puede utilizar como intermediario para los derivados de monoéster o amida, mientras que el cloruro de malonilo es más útil para obtener diésteres o diamidas . En una reacción bien conocida, el ácido malónico se condensa con urea para formar ácido barbitúrico . El ácido malónico también se puede condensar con acetona para formar ácido de Meldrum , un intermediario versátil en transformaciones posteriores. Los ésteres de ácido malónico también se utilizan como un sintón −CH2COOH en la síntesis de ésteres malónicos .
El ácido malónico es un componente clave en la reacción de Briggs-Rauscher , el ejemplo clásico de una reacción química oscilante . [13]
El ácido malónico se utiliza para preparar ácidos carboxílicos a,b-insaturados por condensación y descarboxilación. Los ácidos cinámicos se preparan de esta manera:
En esta, la llamada condensación de Knoevenagel , el ácido malónico se condensa con el grupo carbonilo de un aldehído o cetona , seguido de una descarboxilación .

Cuando el ácido malónico se condensa en piridina caliente, la condensación se acompaña de descarboxilación , la llamada modificación de Doebner . [14] [15] [16]

El ácido malónico no forma fácilmente un anhídrido , la deshidratación produce en su lugar subóxido de carbono :
La transformación se logra calentando una mezcla seca de pentóxido de fósforo ( P 4 O 10 ) y ácido malónico. [17] Reacciona de manera similar al anhídrido malónico , formando malonatos. [18]
El ácido malónico es un precursor de los poliésteres especiales . Se puede convertir en 1,3-propanodiol para su uso en poliésteres y polímeros (cuya utilidad no está clara). También puede ser un componente de las resinas alquídicas , que se utilizan en diversas aplicaciones de revestimientos para proteger contra los daños causados por la luz ultravioleta, la oxidación y la corrosión. Una aplicación del ácido malónico es en la industria de los revestimientos como reticulante para revestimientos en polvo de curado a baja temperatura, que se están volviendo cada vez más valiosos para sustratos sensibles al calor y el deseo de acelerar el proceso de revestimiento. [19] Se estimó que el mercado mundial de revestimientos para automóviles era de 18.590 millones de dólares en 2014 con una tasa de crecimiento anual combinada proyectada del 5,1% hasta 2022. [20]
Se utiliza en diversos procesos de fabricación como un producto químico especializado de alto valor, incluida la industria electrónica , la industria de los sabores y fragancias, [4] los disolventes especiales, la reticulación de polímeros y la industria farmacéutica. En 2004, la producción mundial anual de ácido malónico y diésteres relacionados fue de más de 20.000 toneladas métricas. [21] El crecimiento potencial de estos mercados podría ser resultado de los avances en la biotecnología industrial que buscan desplazar a los productos químicos derivados del petróleo en las aplicaciones industriales.
En 2004, el Departamento de Energía de Estados Unidos incluyó el ácido malónico en la lista de los 30 principales productos químicos que se producen a partir de biomasa. [22]
En aplicaciones de alimentos y medicamentos, el ácido malónico se puede utilizar para controlar la acidez, ya sea como excipiente en formulaciones farmacéuticas o como aditivo conservante natural para alimentos. [4]
El ácido malónico se utiliza como un componente químico básico para producir numerosos compuestos valiosos, [23] incluidos los compuestos de sabor y fragancia gamma-nonalactona, ácido cinámico y el compuesto farmacéutico valproato .
El ácido malónico (hasta 37,5 % p/p) se ha utilizado para reticular almidones de maíz y patata para producir un termoplástico biodegradable; el proceso se realiza en agua utilizando catalizadores no tóxicos. [24] [25] Los polímeros a base de almidón comprendían el 38 % del mercado mundial de polímeros biodegradables en 2014, siendo los envases de alimentos, los envases de espuma y las bolsas de compost los segmentos de uso final más importantes. [26]
La empresa Eastman Kodak y otras utilizan ácido malónico y derivados como adhesivo quirúrgico. [27]
Si los niveles elevados de ácido malónico se acompañan de niveles elevados de ácido metilmalónico , esto puede indicar la enfermedad metabólica aciduria malónica y metilmalónica combinada (CMAMMA). Al calcular la relación entre ácido malónico y ácido metilmalónico en el plasma sanguíneo, la CMAMMA se puede distinguir de la acidemia metilmalónica clásica . [28]
El ácido malónico es el precursor de la síntesis de ácidos grasos mitocondriales (mtFASII), en la que se convierte en malonil-CoA por acción del miembro 3 de la familia de la acil-CoA sintetasa (ACSF3). [29] [30]
Además, el derivado de la coenzima A del malonato, el malonil-CoA, es un precursor importante en la biosíntesis de ácidos grasos citosólicos junto con el acetil-CoA . El malonil-CoA se forma allí a partir del acetil-CoA por la acción de la acetil-CoA carboxilasa , y el malonato se transfiere a una proteína transportadora de acilo para agregarse a una cadena de ácidos grasos.
El ácido malónico es el ejemplo clásico de un inhibidor competitivo de la enzima succinato deshidrogenasa (complejo II), en la cadena de transporte de electrones respiratoria . [31] Se une al sitio activo de la enzima sin reaccionar, compitiendo con el sustrato habitual succinato pero careciendo del grupo −CH 2 CH 2 − necesario para la deshidrogenación. Esta observación se utilizó para deducir la estructura del sitio activo en la succinato deshidrogenasa. La inhibición de esta enzima disminuye la respiración celular. [32] [33] Dado que el ácido malónico es un componente natural de muchos alimentos, está presente en mamíferos, incluidos los humanos. [34]
La versión fluorada del ácido malónico es el ácido difluoromalónico.[1]
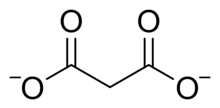
El ácido malónico es diprótico , es decir, puede donar dos protones por molécula. El primero es 2,8 y el segundo 5,7. [2] Por lo tanto, el ion malonato puede ser H O O C CH 2 COO − o C H 2 (C O O) 2−2Los compuestos de malonato o propanodioato incluyen sales y ésteres de ácido malónico, como