Las ADN glicosilasas son una familia de enzimas implicadas en la reparación por escisión de bases , clasificadas con el número EC EC 3.2.2. La reparación por escisión de bases es el mecanismo mediante el cual las bases dañadas en el ADN se eliminan y reemplazan. Las ADN glicosilasas catalizan el primer paso de este proceso. Eliminan la base nitrogenada dañada mientras dejan intacta la columna vertebral de azúcar-fosfato, creando un sitio apurínico/apirimidínico, comúnmente conocido como sitio AP . Esto se logra sacando la base dañada de la doble hélice, seguido de la escisión del enlace N-glicosídico . [1]
Las glicosilasas se descubrieron por primera vez en bacterias y desde entonces se han encontrado en todos los reinos de la vida. Además de su papel en la reparación por escisión de bases, las enzimas ADN glicosilasa han estado implicadas en la represión del silenciamiento de genes en A. thaliana , N. tabacum y otras plantas mediante desmetilación activa. Los residuos de 5-metilcitosina se eliminan y reemplazan con citosinas no metiladas, lo que permite el acceso a la estructura de la cromatina de las enzimas y proteínas necesarias para la transcripción y la traducción posterior. [2] [3]
Hay dos clases principales de glicosilasas: monofuncionales y bifuncionales. Las glicosilasas monofuncionales solo tienen actividad glicosilasa, mientras que las glicosilasas bifuncionales también poseen actividad AP liasa que les permite cortar el enlace fosfodiéster del ADN, creando una rotura monocatenaria sin necesidad de una endonucleasa AP . La β-eliminación de un sitio AP por una glicosilasa-liasa produce un aldehído 3' α,β-insaturado adyacente a un fosfato 5', que difiere del producto de escisión de la endonucleasa AP. [4] Algunas glicosilasa-liasas pueden realizar además una eliminación δ, que convierte el aldehído 3' en un fosfato 3'.
La primera estructura cristalina de una ADN glicosilasa se obtuvo para E. coli Nth. [5] Esta estructura reveló que la enzima saca la base dañada de la doble hélice y la coloca en un bolsillo del sitio activo para poder extirparla. Desde entonces se ha descubierto que otras glicosilasas siguen el mismo paradigma general, incluida la UNG humana que se muestra a continuación. Para romper el enlace N-glucosídico, las glicosilasas monofuncionales utilizan una molécula de agua activada para atacar el carbono 1 del sustrato. Las glicosilasas bifuncionales, en cambio, utilizan un residuo de amina como nucleófilo para atacar el mismo carbono, pasando por una base intermedia de Schiff .
Se han resuelto las estructuras cristalinas de muchas glicosilasas. Según la similitud estructural, las glicosilasas se agrupan en cuatro superfamilias. Las familias UDG y AAG contienen glicosilasas pequeñas y compactas, mientras que las familias MutM/Fpg y HhH-GPD comprenden enzimas más grandes con múltiples dominios. [4]
Una amplia variedad de glicosilasas han evolucionado para reconocer diferentes bases dañadas. La siguiente tabla resume las propiedades de las glicosilasas conocidas en organismos modelo comúnmente estudiados.
Las ADN glicosilasas se pueden agrupar en las siguientes categorías según su(s) sustrato(s):

En biología molecular, la familia de proteínas uracilo-ADN glicosilasa (UDG) es una enzima que revierte mutaciones en el ADN. La mutación más común es la desaminación de citosina a uracilo . UDG repara estas mutaciones. La UDG es crucial en la reparación del ADN ; sin ella, estas mutaciones pueden provocar cáncer . [8]
Esta entrada representa varias uracilo-ADN glicosilasas y ADN glicosilasas (EC) relacionadas, como la uracilo-ADN glicosilasa, [9] uracilo-ADN glicosilasa termófila , [10] ADN glicosilasa específica de desajuste G:T/U (Mug), [ 11] y uracilo-DNA glicosilasa monofuncional selectiva monocatenaria (SMUG1). [12]
Las uracilo ADN glicosilasas eliminan el uracilo del ADN, lo que puede surgir por desaminación espontánea de la citosina o por la mala incorporación de dU frente a dA durante la replicación del ADN . El miembro prototípico de esta familia es E. coli UDG, que estuvo entre las primeras glicosilasas descubiertas. Se han identificado cuatro actividades diferentes de uracilo-ADN glicosilasa en células de mamíferos, incluidas UNG , SMUG1 , TDG y MBD4 . Varían en la especificidad del sustrato y la localización subcelular. SMUG1 prefiere el ADN monocatenario como sustrato, pero también elimina el U del ADN bicatenario. Además del uracilo no modificado, SMUG1 puede escindir 5-hidroxiuracilo, 5-hidroximetiluracilo y 5-formiluracilo que llevan un grupo oxidado en el anillo C5. [13] TDG y MBD4 son estrictamente específicos del ADN bicatenario. El TDG puede eliminar el timina glicol cuando está presente frente a la guanina, así como los derivados de U con modificaciones en el carbono 5. La evidencia actual sugiere que, en las células humanas, el TDG y SMUG1 son las principales enzimas responsables de la reparación de los pares U:G causados por La desaminación espontánea de la citosina, mientras que el uracilo que surge en el ADN a través de la incorporación errónea de dU es tratado principalmente por la UNG. Se cree que MBD4 corrige los desajustes T:G que surgen de la desaminación de 5-metilcitosina a timina en sitios CpG. [14] Los ratones mutantes MBD4 se desarrollan normalmente y no muestran una mayor susceptibilidad al cáncer ni una supervivencia reducida. Pero adquieren más mutaciones CT en secuencias CpG en las células epiteliales del intestino delgado. [15]
La estructura de la UNG humana en complejo con el ADN reveló que, al igual que otras glicosilasas, saca el nucleótido objetivo de la doble hélice y lo introduce en el bolsillo del sitio activo. [16] UDG sufre un cambio conformacional de un estado "abierto" no unido a un estado "cerrado" unido al ADN. [17]
Lindahl fue la primera en observar la reparación del uracilo en el ADN. La UDG se purificó a partir de Escherichia coli y esto hidrolizó el enlace N-glucosídico que conecta la base con el azúcar desoxirribosa de la columna vertebral del ADN. [8]
La función de UDG es eliminar mutaciones en el ADN, más específicamente eliminar uracilo.
Estas proteínas tienen una estructura alfa/beta/alfa de 3 capas . La topología polipeptídica de UDG es la de una proteína alfa/beta clásica. La estructura consta principalmente de una lámina beta central, de cuatro hebras, totalmente paralela, rodeada a cada lado por un total de ocho hélices alfa y se denomina lámina beta paralela de doble enrollamiento. [9]
Las uracilo-ADN glicosilasas son enzimas reparadoras del ADN que escinden los residuos de uracilo del ADN escindiendo el enlace N-glucosídico, iniciando la vía de reparación por escisión de bases . El uracilo en el ADN puede surgir mediante la desaminación de la citosina para formar pares mutagénicos U:G, o mediante la incorporación de dUMP por la ADN polimerasa para formar pares U:A . [18] Estos residuos aberrantes de uracilo son genotóxicos. [19]
En las células eucariotas , la actividad UNG se encuentra tanto en el núcleo como en las mitocondrias . La proteína UNG1 humana se transporta tanto a las mitocondrias como al núcleo . [20]
La secuencia de la uracilo-ADN glicosilasa está extremadamente bien conservada [21] en bacterias y eucariotas, así como en virus del herpes . En los poxvirus también se encuentran uracilo-ADN glicosilasas más lejanamente relacionadas . [22] Los 77 aminoácidos N-terminales de UNG1 parecen ser necesarios para la localización mitocondrial , pero no se ha demostrado directamente la presencia de un péptido de tránsito mitocondrial . La región conservada más N-terminal contiene un residuo de ácido aspártico que se ha propuesto, basándose en estructuras de rayos X [23], para actuar como base general en el mecanismo catalítico .
Hay dos familias de UDG, denominadas Familia 1 y Familia 2. La familia 1 es activa contra el uracilo en ssDNA y dsDNA. "La familia 2 elimina el uracilo de los desajustes con la guanina" . [8]
Una variedad de glicosilasas han evolucionado para reconocer bases oxidadas, que comúnmente se forman por especies reactivas de oxígeno generadas durante el metabolismo celular. Las lesiones más abundantes formadas en los residuos de guanina son 2,6-diamino-4-hidroxi-5-formamidopirimidina (FapyG) y 8-oxoguanina . Debido al emparejamiento incorrecto con la adenina durante la replicación, el 8-oxoG es altamente mutagénico y produce transversiones de G a T. La reparación de esta lesión es iniciada por la ADN glicosilasa bifuncional OGG1 , que reconoce 8-oxoG emparejado con C. hOGG1 es una glicosilasa bifuncional que pertenece a la familia hélice-horquilla-hélice (HhH). MYH reconoce la adenina mal emparejada con 8-oxoG pero corta la A, dejando la 8-oxoG intacta. Los ratones knockout para OGG1 no muestran una mayor incidencia de tumores, pero acumulan 8-oxoG en el hígado a medida que envejecen. [24] Se observa un fenotipo similar con la inactivación de MYH, pero la inactivación simultánea de MYH y OGG1 provoca la acumulación de 8-oxoG en múltiples tejidos, incluidos el pulmón y el intestino delgado. [25] En los seres humanos, las mutaciones en MYH se asocian con un mayor riesgo de desarrollar pólipos de colon y cáncer de colon . Además de OGG1 y MYH, las células humanas contienen tres ADN glicosilasas adicionales, NEIL1 , NEIL2 y NEIL3 . Estos son homólogos de la Nei bacteriana y su presencia probablemente explica los fenotipos leves de los ratones knockout para OGG1 y MYH.
Este grupo incluye E. coli AlkA y proteínas relacionadas en eucariotas superiores. Estas glicosilasas son monofuncionales y reconocen bases metiladas, como la 3-metiladenina.
AlkA se refiere a 3-metiladenina ADN glicosilasa II . [26]
Las alteraciones epigenéticas (epimutaciones) en los genes de la ADN glicosilasa han comenzado a evaluarse recientemente en algunos cánceres, en comparación con los numerosos estudios previos de epimutaciones en genes que actúan en otras vías de reparación del ADN (como MLH1 en la reparación de errores de coincidencia y MGMT en la reversión directa). . [ cita necesaria ] A continuación se resumen dos ejemplos de epimutaciones en los genes de la ADN glicosilasa que ocurren en los cánceres.

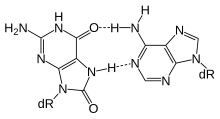
MBD4 (proteína 4 del dominio de unión a metil-CpG) es una glicosilasa empleada en un paso inicial de reparación por escisión de bases. La proteína MBD4 se une preferentemente a sitios CpG completamente metilados . [28] Estas bases alteradas surgen de la frecuente hidrólisis de citosina a uracilo (ver imagen) y de la hidrólisis de 5-metilcitosina a timina, produciendo pares de bases G:U y G:T. [29] Si los uracilos o timinas inadecuados en estos pares de bases no se eliminan antes de la replicación del ADN, causarán mutaciones de transición . MBD4 cataliza específicamente la eliminación de T y U emparejadas con guanina (G) dentro de los sitios CpG. [30] Esta es una función de reparación importante ya que aproximadamente 1/3 de todas las mutaciones intragénicas de un solo par de bases en cánceres humanos ocurren en dinucleótidos CpG y son el resultado de transiciones de G:C a A:T. [30] [31] Estas transiciones comprenden las mutaciones más frecuentes en el cáncer humano. Por ejemplo, casi el 50% de las mutaciones somáticas del gen supresor de tumores p53 en el cáncer colorrectal son transiciones G:C a A:T dentro de sitios CpG. [30] Por lo tanto, una disminución en la expresión de MBD4 podría causar un aumento de mutaciones cancerígenas .
La expresión de MBD4 se reduce en casi todas las neoplasias colorrectales debido a la metilación de la región promotora de MBD4. [32] Además, MBD4 es deficiente debido a una mutación en aproximadamente el 4% de los cánceres colorrectales, [33]
La mayoría de los campos histológicamente normales que rodean crecimientos neoplásicos (adenomas y cánceres de colon) en el colon también muestran una expresión reducida del ARNm de MBD4 (un defecto de campo ) en comparación con el tejido histológicamente normal de individuos que nunca tuvieron una neoplasia de colon. [32] Este hallazgo sugiere que el silenciamiento epigenético de MBD4 es un paso temprano en la carcinogénesis colorrectal .
En una población china que fue evaluada, el polimorfismo MBD4 Glu346Lys se asoció con aproximadamente un 50 % menos de riesgo de cáncer de cuello uterino, lo que sugiere que las alteraciones en MBD4 son importantes en este cáncer. [34]
Nei-like (NEIL) 1 es una ADN glicosilasa de la familia Nei (que también contiene NEIL2 y NEIL3). [35] NEIL1 es un componente del complejo de replicación del ADN necesario para la vigilancia de las bases oxidadas antes de la replicación, y parece actuar como un "atrapador de vacas" para retardar la replicación hasta que NEIL1 pueda actuar como una glicosilasa y eliminar la base dañada por oxidación. [35]
La proteína NEIL1 reconoce (objetivo) y elimina ciertas bases dañadas por oxidación y luego corta el sitio abásico mediante eliminación β, δ, dejando extremos fosfato 3 'y 5'. NEIL1 reconoce pirimidinas oxidadas , formamidopirimidinas, residuos de timina oxidados en el grupo metilo y ambos estereoisómeros de timinglicol . [36] Los mejores sustratos para NEIL1 humano parecen ser las lesiones de hidantoína , guanidinohidantoína y espiroiminodihidantoína, que son productos de oxidación adicionales de 8-oxoG . NEIL1 también es capaz de eliminar lesiones del ADN monocatenario, así como de estructuras de ADN bifurcadas y de burbujas. Una deficiencia en NEIL1 provoca un aumento de la mutagénesis en el sitio de un par 8-oxo-Gua:C, siendo la mayoría de las mutaciones transversiones de G:C a T:A. [37]
Un estudio realizado en 2004 encontró que el 46% de los cánceres gástricos primarios tenían una expresión reducida del ARNm de NEIL1 , aunque se desconocía el mecanismo de reducción. [38] Este estudio también encontró que el 4% de los cánceres gástricos tenían mutaciones en el gen NEIL1. Los autores sugirieron que la baja actividad de NEIL1 derivada de una expresión reducida y/o mutación del gen NEIL1 a menudo estaba implicada en la carcinogénesis gástrica.
Se realizó una selección de 145 genes de reparación del ADN para detectar la metilación aberrante del promotor en tejidos de carcinoma de células escamosas de cabeza y cuello (HNSCC) de 20 pacientes y de muestras de mucosa de cabeza y cuello de 5 pacientes sin cáncer. [39] Esta prueba mostró que el gen NEIL1 había aumentado sustancialmente la hipermetilación, y de los 145 genes de reparación del ADN evaluados, NEIL1 tenía la frecuencia de metilación más significativamente diferente. Además, la hipermetilación correspondió a una disminución en la expresión del ARNm de NEIL1. Trabajos adicionales con 135 tejidos tumorales y 38 tejidos normales también mostraron que el 71% de las muestras de tejido HNSCC tenían una metilación elevada del promotor NEIL1. [39]
Cuando se evaluaron 8 genes de reparación del ADN en tumores de cáncer de pulmón de células no pequeñas (CPCNP), el 42 % estaban hipermetilados en la región promotora NEIL1. [40] Esta fue la anomalía de reparación del ADN más frecuente encontrada entre los 8 genes de reparación del ADN analizados. NEIL1 también fue uno de los seis genes de reparación del ADN que se encontraron hipermetilados en sus regiones promotoras en el cáncer colorrectal . [41]
{{cite book}}: |journal=ignorado ( ayuda )