El polonio-210 ( 210 Po, Po-210, históricamente radio F ) es un isótopo del polonio . Sufre desintegración alfa en 206 Pb estable con una vida media de 138,376 días (aproximadamente 4+1 ⁄ 2 meses), la vida media más larga de todos los isótopos de polonio que se encuentran en la naturaleza ( 210–218 Po). [1] Identificado por primera vez en 1898, y que también marca el descubrimiento del elemento polonio, el 210 Po se genera en la cadena de desintegración del uranio-238 y el radio-226 . El 210 Po es un contaminante destacado en el medio ambiente, que afecta principalmente a los mariscos y al tabaco . Su extrema toxicidad se atribuye a la intensa radiactividad, principalmente debido a las partículas alfa , que fácilmente causan daños por radiación, incluido el cáncer en el tejido circundante. La actividad específica de210
El Po es de 166 TBq/g, es decir , 1,66 × 10 14 Bq/g. Al mismo tiempo, el 210 Po no se detecta fácilmente con los detectores de radiación comunes, porque sus rayos gamma tienen una energía muy baja. Por lo tanto,210
Po puede considerarse un emisor alfa cuasi puro.

En 1898, Marie y Pierre Curie descubrieron una sustancia fuertemente radiactiva en la pechblenda y determinaron que se trataba de un nuevo elemento; fue uno de los primeros elementos radiactivos descubiertos. Habiéndolo identificado como tal, llamaron al elemento polonio en honor al país de origen de Marie, Polonia . Willy Marckwald descubrió una actividad radiactiva similar en 1902 y la llamó radiotelurio , y aproximadamente al mismo tiempo, Ernest Rutherford identificó la misma actividad en su análisis de la cadena de desintegración del uranio y la llamó radio F (originalmente radio E ). En 1905, Rutherford concluyó que todas estas observaciones se debían a la misma sustancia, 210 Po. Descubrimientos posteriores y el concepto de isótopos, propuesto por primera vez en 1913 por Frederick Soddy , colocaron firmemente al 210 Po como el penúltimo paso en la serie del uranio . [3]
En 1943, se estudió el 210Po como posible iniciador de neutrones en armas nucleares , como parte del Proyecto Dayton . En las décadas posteriores, las preocupaciones por la seguridad de los trabajadores que manipulaban 210Po llevaron a realizar estudios exhaustivos sobre sus efectos en la salud. [4]
En la década de 1950, los científicos de la Comisión de Energía Atómica de los Estados Unidos en los Laboratorios Mound , Ohio, exploraron la posibilidad de utilizar 210 Po en generadores termoeléctricos de radioisótopos (RTG) como fuente de calor para alimentar satélites. En 1958 se desarrolló una batería atómica de 2,5 vatios que utilizaba 210 Po. Sin embargo, se eligió el isótopo plutonio-238 , ya que tiene una vida media más larga de 87,7 años. [5]
El polonio-210 fue utilizado para matar al disidente ruso y ex oficial del FSB Alexander V. Litvinenko en 2006, [6] [7] y fue sospechoso como una posible causa de la muerte de Yasser Arafat , luego de la exhumación y análisis de su cadáver en 2012-2013. [8] El radioisótopo también puede haber sido utilizado para matar a Yuri Shchekochikhin , Lecha Islamov y Roman Tsepov . [9]
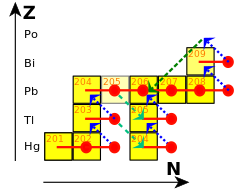
El 210 Po es un emisor alfa que tiene una vida media de 138,376 días; [1] se desintegra directamente en 206 Pb estable . La mayoría de las veces, el 210 Po se desintegra mediante la emisión de una partícula alfa únicamente, no mediante la emisión de una partícula alfa y un rayo gamma ; aproximadamente una de cada 100.000 desintegraciones da como resultado la emisión de un rayo gamma. [10]
Esta baja tasa de producción de rayos gamma hace que sea más difícil encontrar e identificar este isótopo. En lugar de la espectroscopia de rayos gamma , la espectroscopia alfa es el mejor método para medir este isótopo.
Debido a su vida media mucho más corta, un miligramo de 210 Po emite tantas partículas alfa por segundo como 5 gramos de 226 Ra . [11] Unos pocos curies de 210 Po emiten un brillo azul causado por la excitación del aire circundante.
El 210 Po se encuentra en cantidades minúsculas en la naturaleza, donde es el penúltimo isótopo en la cadena de desintegración de la serie del uranio . Se genera mediante la desintegración beta a partir del 210 Pb y el 210 Bi .
El proceso astrofísico s termina con la desintegración del 210 Po, ya que el flujo de neutrones es insuficiente para provocar más capturas de neutrones en la corta vida del 210 Po. En cambio, el 210 Po alfa se desintegra en 206 Pb, que luego captura más neutrones para convertirse en 210 Po y repite el ciclo, consumiendo así los neutrones restantes. Esto da como resultado una acumulación de plomo y bismuto, y garantiza que los elementos más pesados, como el torio y el uranio, solo se produzcan en el proceso r, mucho más rápido . [12]
Aunque el 210 Po se encuentra en cantidades traza en la naturaleza, no es lo suficientemente abundante (0,1 ppb ) como para que sea factible su extracción del mineral de uranio. En cambio, la mayor parte del 210 Po se produce sintéticamente, mediante el bombardeo de neutrones de 209 Bi en un reactor nuclear . Este proceso convierte el 209 Bi en 210 Bi, que se desintegra en 210 Po con una vida media de cinco días. Mediante este método, se producen aproximadamente 8 gramos (0,28 oz) de 210 Po en Rusia y se envían a los Estados Unidos cada mes para aplicaciones comerciales. [4] Al irradiar ciertas sales de bismuto que contienen núcleos de elementos ligeros como el berilio, también se puede inducir una reacción en cascada (α,n) para producir 210 Po en grandes cantidades. [13]
La producción de polonio-210 es una desventaja de los reactores refrigerados con plomo-bismuto eutéctico en lugar de plomo puro. Sin embargo, dadas las propiedades eutécticas de esta aleación, algunos diseños de reactores de Generación IV propuestos aún dependen del plomo-bismuto.
Un solo gramo de 210 Po genera 140 vatios de potencia. [14] Debido a que emite muchas partículas alfa , que se detienen a una distancia muy corta en medios densos y liberan su energía, el 210 Po se ha utilizado como una fuente de calor ligera para alimentar células termoeléctricas en satélites artificiales . Una fuente de calor de 210 Po también estaba en cada uno de los rovers Lunokhod desplegados en la superficie de la Luna , para mantener sus componentes internos calientes durante las noches lunares. [15] Algunos cepillos antiestáticos, utilizados para neutralizar la electricidad estática en materiales como la película fotográfica, contienen unos pocos microcurios de 210 Po como fuente de partículas cargadas. [16] El 210 Po también se utilizó en iniciadores para bombas atómicas a través de la reacción (α,n) con berilio . [17] Las pequeñas fuentes de neutrones que dependen de la reacción (α,n) también suelen utilizar polonio como una fuente conveniente de partículas alfa debido a sus emisiones gamma comparativamente bajas (que permiten un fácil blindaje) y su alta actividad específica .
El 210 Po es extremadamente tóxico; este y otros isótopos del polonio son algunas de las sustancias más radiotóxicas para los humanos. [6] [18] Con un microgramo de 210 Po siendo más que suficiente para matar al adulto promedio, es 250.000 veces más tóxico que el cianuro de hidrógeno en peso. [19] Un gramo de 210 Po sería hipotéticamente suficiente para matar a 50 millones de personas y enfermar a otros 50 millones. [6] Esto es una consecuencia de su radiación alfa ionizante , ya que las partículas alfa son especialmente dañinas para los tejidos orgánicos dentro del cuerpo. Sin embargo, el 210 Po no representa un peligro de radiación cuando se encuentra fuera del cuerpo. [20] Las partículas alfa que produce no pueden penetrar la capa externa de las células cutáneas muertas. [21]
La toxicidad del 210 Po se debe enteramente a su radiactividad. No es químicamente tóxico en sí mismo, pero su solubilidad en solución acuosa , así como la de sus sales, plantean un peligro porque su propagación por todo el cuerpo se facilita en solución. [6] La ingestión de 210 Po se produce principalmente a través del aire, los alimentos o el agua contaminados, así como a través de heridas abiertas. Una vez dentro del cuerpo, el 210 Po se concentra en los tejidos blandos (especialmente en el sistema reticuloendotelial ) y en el torrente sanguíneo . Su vida media biológica es de aproximadamente 50 días. [22]
En el medio ambiente, el 210 Po puede acumularse en los mariscos. [23] Se ha detectado en varios organismos en el Mar Báltico , donde puede propagarse y, por lo tanto, contaminar la cadena alimentaria. [18] También se sabe que el 210 Po contamina la vegetación, principalmente a partir de la descomposición del radón-222 atmosférico y la absorción del suelo. [24]
En particular, el 210 Po se adhiere a las hojas de tabaco y se concentra en ellas. [4] [22] Ya en 1964 se documentaron concentraciones elevadas de 210 Po en el tabaco, y se descubrió que los fumadores de cigarrillos estaban expuestos a dosis considerablemente mayores de radiación de 210 Po y su progenitor, el 210 Pb. [24] Los fumadores empedernidos pueden estar expuestos a la misma cantidad de radiación (las estimaciones varían de 100 µSv [18] a 160 mSv [25] por año) que los individuos en Polonia a causa de la lluvia radiactiva de Chernóbil que viajaron desde Ucrania. [18] Como resultado, el 210 Po es más peligroso cuando se inhala del humo del cigarrillo. [26]