Compuesto químico
El 2,5-dimetilfurano es un compuesto heterocíclico con la fórmula (CH 3 ) 2 C 4 H 2 O. Aunque a menudo se abrevia como DMF , no debe confundirse con dimetilformamida . Un derivado del furano , este compuesto simple es un biocombustible potencial , ya que se deriva de la celulosa.
Producción
La fructosa se puede convertir en 2,5-dimetilfurano en un proceso catalítico de biomasa a líquido . La conversión de fructosa en DMF se realiza mediante hidroximetilfurfural . [3] [4]
La fructosa se obtiene a partir de la glucosa, un componente básico de la celulosa. [5] [6]
Potencial como biocombustible
El DMF tiene numerosos atractivos como biocombustible . Tiene una densidad energética un 40% mayor que la del etanol , por lo que es comparable a la gasolina (gasolina). También es químicamente estable y, al ser insoluble en agua, no absorbe humedad de la atmósfera. La evaporación del dimetilfurano durante el proceso de producción también requiere alrededor de un tercio menos de energía que la evaporación del etanol, [3] [7] aunque tiene un punto de ebullición unos 14 °C más alto, a 92 °C, en comparación con los 78 °C del etanol.
La capacidad de producir dimetilfurano de manera eficiente y rápida a partir de fructosa, que se encuentra en frutas y algunos tubérculos , o de glucosa, que puede derivarse del almidón y la celulosa (todos ampliamente disponibles en la naturaleza), aumenta el atractivo del dimetilfurano, aunque se deben abordar cuestiones de seguridad. examinado. El bioetanol y el biodiesel son actualmente los principales biocombustibles líquidos.
La relación estequiométrica aire/combustible del dimetilfurano es 10,72, en comparación con el etanol de 8,95 y la gasolina de 14,56. [2] Esto significa que quemar dimetilfurano requiere aproximadamente un 33% menos de aire que la misma cantidad de gasolina, pero aproximadamente un 20% más de aire que la misma cantidad de etanol.
El poder calorífico del dimetilfurano líquido es de 33,7 MJ/kg, en comparación con los 26,9 MJ/kg del etanol y los 43,2 MJ/kg de la gasolina. [2] El índice de octano de investigación (RON) del dimetilfurano es 119. [2] El calor latente de vaporización a 20 °C es 31,91 kJ/mol. [2] Pruebas recientes en un motor de gasolina de un solo cilindro encontraron que la eficiencia térmica de la quema de dimetilfurano es similar a la de la gasolina. [8]
Otros usos
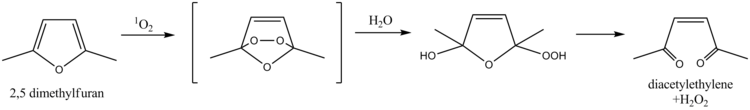
El 2,5-dimetilfurano sirve como eliminador del oxígeno singlete , una propiedad que se ha aprovechado para la determinación del oxígeno singlete en aguas naturales. El mecanismo implica una reacción de Diels-Alder seguida de hidrólisis , que finalmente conduce a diacetiletileno y peróxido de hidrógeno como productos. Más recientemente, se ha utilizado alcohol furfurílico con el mismo fin. [9]
También se ha propuesto el 2,5-dimetilfurano como estándar interno para la espectroscopia de RMN . El 2,5-dimetilfurano tiene singletes en su espectro de 1H NMR en δ 2,2 y 5,8; los singletes dan integraciones confiables, mientras que las posiciones de los picos no interfieren con muchos analitos. El compuesto también tiene un punto de ebullición apropiado de 92 °C que evita pérdidas por evaporación, pero se elimina fácilmente. [10]
Papel en la química de los alimentos
El 2,5-dimetilfurano se forma tras la degradación térmica de algunos azúcares y se ha identificado en pequeñas cantidades como un componente de los azúcares caramelizados . [11]
Toxicología
El 2,5-dimetilfurano desempeña un papel en el mecanismo de neurotoxicidad del hexano en humanos. Junto con la hexano-2,5-diona y la 4,5-dihidroxi-2-hexanona, es uno de los principales metabolitos del hexano . [12]
El 2,5-dimetilfurano ha sido identificado como uno de los componentes del humo del cigarro con baja toxicidad ciliar (capacidad de afectar negativamente a los cilios del tracto respiratorio que son responsables de eliminar partículas extrañas). [13] Su concentración en sangre se puede utilizar como biomarcador del tabaquismo . [14]
La comparación de las hojas de datos de seguridad muestra que la manipulación humana del 2,5-dimetilfurano [15] [16] [17] es aproximadamente tan peligrosa como la manipulación de gasolina. [18] [19] [20]
Referencias
- ^ ab "Directorio de productos químicos ChemExper - Catálogo de productos químicos y proveedores". Archivado desde el original el 27 de septiembre de 2011 . Consultado el 17 de marzo de 2011 .
- ^ abcde "Un estudio sobre motores de inyección directa encuentra que el DMF es un biocombustible prometedor, con un rendimiento de combustión y emisiones reguladas comparables a las de la gasolina | Respetuoso con el medio ambiente". Archivado desde el original el 21 de enero de 2013.
- ^ ab Yuriy Román-Leshkov; Christopher J. Barrett; Zhen Y. Liu; James A. Dumesic (2007). "Producción de dimetilfurano para combustibles líquidos a partir de carbohidratos derivados de biomasa". Naturaleza . 447 (7147): 982–5. Código Bib :2007Natur.447..982R. doi : 10.1038/naturaleza05923. PMID 17581580. S2CID 4366510.
- ^ Matt McGrath (21 de junio de 2007). "La fruta podría ser un 'combustible potente'". Noticias de la BBC . Archivado desde el original el 17 de agosto de 2007 . Consultado el 22 de junio de 2007 .
- ^ Haibo Zhao; Johnathan E. Holladay; brezo marrón; Z. Conrad Zhang (15 de junio de 2007). "Los cloruros metálicos en disolventes líquidos iónicos convierten los azúcares en 5-hidroximetilfurfural". Ciencia . 316 (5831): 1597–1600. Código bibliográfico : 2007 Ciencia... 316.1597Z. doi : 10.1126/ciencia.1141199. PMID 17569858. S2CID 39295324.
- ^ "Plástico que crece en los árboles". Laboratorio Nacional del Noroeste del Pacífico. 2007-06-21. Archivado desde el original (nota de prensa) el 13 de julio de 2007 . Consultado el 22 de junio de 2007 .
- ^ James Beal (20 de junio de 2007). "Los ingenieros desarrollan a partir del azúcar un combustible para el transporte de líquidos de mayor energía" (nota de prensa) . Universidad de Wisconsin-Madison. Archivado desde el original el 1 de julio de 2007 . Consultado el 22 de junio de 2007 .
- ^ "Congreso de automóviles ecológicos: un estudio sobre motores de inyección directa revela que el DMF es un biocombustible prometedor, con un rendimiento de combustión y emisiones reguladas comparables a las de la gasolina". Archivado desde el original el 24 de diciembre de 2011 . Consultado el 17 de marzo de 2011 .
- ^ Patrick L. Brezonik. Cinética química y dinámica de procesos en sistemas acuáticos . Prensa CRC, 1994, pág. 671. [1] Archivado el 24 de julio de 2020 en Wayback Machine.
- ^ SO Gerritz; AM Sefler (2000). "2,5-dimetilfurano (DMFu): un estándar interno para la cuantificación" sin rastro "de muestras desconocidas mediante RMN 1H". J. peine. Química. 2 (1): 39–41. doi :10.1021/cc990041v. PMID 10813883.
- ^ WD Powrie; CH Wu; Vicepresidente Molund (1986). "Sistemas de reacción de pardeamiento como fuente de mutágenos y antimutágenos". Perspectivas de salud ambiental . 67 : 47–54. doi :10.2307/3430317. JSTOR 3430317. PMC 1474410 . PMID 3757959.
- ^ Peter Arlien-Søborg. Neurotoxicidad de los disolventes . Prensa CRC, 1992. ISBN 0-8493-6234-2 . [2] Archivado el 21 de febrero de 2021 en Wayback Machine.
- ^ Donald Shopland. Cigarros: efectos y tendencias sobre la salud . DIANE Publishing, 1998. [3] Archivado el 24 de julio de 2020 en Wayback Machine.
- ^ Ashley, DL; Bonin, MA; Hamar, B.; McGeehin, M. (1996). "Uso de la concentración sanguínea de 2,5-dimetilfurano como marcador de tabaquismo". Archivos Internacionales de Salud Ocupacional y Ambiental . 68 (3): 183–7. Código Bib : 1996IAOEH..68..183A. doi :10.1007/BF00381629. PMID 8919847. S2CID 22233967. Archivado desde el original el 21 de febrero de 2021 . Consultado el 12 de septiembre de 2020 .
- ^ "Ficha de datos de seguridad: 2,5-dimetilfurano". Termo Fisher Scientific . Archivado desde el original el 7 de marzo de 2014 . Consultado el 7 de marzo de 2014 .
- ^ "2,5-dimetilfurano (625-86-5)". Libro Químico . Archivado desde el original el 4 de mayo de 2017 . Consultado el 21 de julio de 2017 .
- ^ "Ficha de datos de seguridad del material 2,5-dimetilfurano" (PDF) . 6 de enero de 2012. Archivado (PDF) desde el original el 4 de agosto de 2022.
- ^ "Servicios Equiva - MSDS". Archivado desde el original el 10 de julio de 2011.
- ^ "peligro.com". Archivado desde el original el 11 de julio de 2011 . Consultado el 27 de diciembre de 2010 .
{{cite web}}: Mantenimiento CS1: URL no apta ( enlace ) - ^ "peligro.com". Archivado desde el original el 11 de julio de 2011 . Consultado el 27 de diciembre de 2010 .
{{cite web}}: Mantenimiento CS1: URL no apta ( enlace )