El 1-propanol (también propan -1-ol , propanol , alcohol n-propílico ) es un alcohol primario con la fórmula CH3CH2CH2OH y en ocasiones representado como PrOH o n -PrOH . Es un líquido incoloro y un isómero del 2-propanol . Se forma naturalmente en pequeñas cantidades durante muchos procesos de fermentación y se utiliza como disolvente en la industria farmacéutica, principalmente para resinas y ésteres de celulosa , y, en ocasiones, como agente desinfectante .
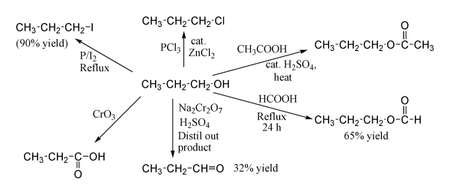
El 1-Propanol muestra las reacciones normales de un alcohol primario . Por tanto, puede convertirse en haluros de alquilo ; por ejemplo, el fósforo rojo y el yodo producen yoduro de n-propilo con un rendimiento del 80%, mientras que el PCl 3 con ZnCl 2 catalítico da cloruro de n-propilo . La reacción con ácido acético en presencia de un catalizador de H 2 SO 4 en condiciones de esterificación de Fischer da acetato de propilo , mientras que el propanol a reflujo durante la noche con ácido fórmico solo puede producir formiato de propilo con un rendimiento del 65 %. La oxidación de 1-propanol con Na 2 Cr 2 O 7 y H 2 SO 4 da un rendimiento del 36% de propionaldehído y, por lo tanto, para este tipo de reacción se recomiendan métodos de mayor rendimiento utilizando PCC o oxidación de Swern . La oxidación con ácido crómico produce ácido propiónico .
El 1-propanol se fabrica mediante hidrogenación catalítica de propionaldehído . El propionaldehído se produce mediante el proceso oxo mediante hidroformilación de etileno utilizando monóxido de carbono e hidrógeno en presencia de un catalizador como cobalto octacarbonilo o un complejo de rodio . [5]
Una preparación de laboratorio tradicional de 1-propanol implica el tratamiento de yoduro de n -propilo con Ag 2 O húmedo .
Se cree que el 1-propanol es similar al etanol en sus efectos en el cuerpo humano, pero entre 2 y 4 veces más potente según un estudio realizado en conejos. Muchos estudios de toxicología encuentran que la LD 50 oral aguda oscila entre 1,9 g/kg y 6,5 g/kg (en comparación con 7,06 g/kg para el etanol). Se metaboliza en ácido propiónico . Los efectos incluyen intoxicación alcohólica y acidosis metabólica con brecha aniónica alta . En 2011, se informó de un caso de intoxicación letal tras la ingestión oral de 500 ml de 1-propanol. [6] Debido a la falta de datos a largo plazo, se desconoce la carcinogenicidad del 1-propanol en seres humanos.
El 1-propanol tiene un alto índice de octanaje y es adecuado para el uso de combustible en motores . Sin embargo, el propanol es demasiado caro para utilizarlo como combustible para motores. El índice de octanaje de investigación (RON) del propanol es 118 y el índice antidetonación (IRA) es 108. [7]