El sulfuro de mercurio , o sulfuro de mercurio (II), es un compuesto químico formado por los elementos químicos mercurio y azufre . Se representa por la fórmula química HgS. Es prácticamente insoluble en agua. [4]
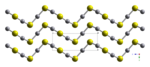

El HgS es dimórfico con dos formas cristalinas:
El β-HgS precipita como un sólido negro cuando las sales de Hg(II) se tratan con H2S . La reacción se lleva a cabo convenientemente con una solución de ácido acético de acetato de mercurio(II) . Con un calentamiento suave de la suspensión, el polimorfo negro se convierte en la forma roja. [6] El β-HgS no reacciona con ningún ácido excepto con los ácidos concentrados. [4]
El mercurio se produce a partir del mineral de cinabrio tostándolo al aire y condensando el vapor. [4]

Cuando se utiliza α-HgS como pigmento rojo, se le conoce como cinabrio . La tendencia del cinabrio a oscurecerse se ha atribuido a la conversión de α-HgS rojo a β-HgS negro. Sin embargo, no se detectó β-HgS en las excavaciones de Pompeya, donde originalmente las paredes rojas se oscurecieron, y se atribuyó a la formación de compuestos de Hg-Cl (por ejemplo, corderoita , calomelanos y terlinguaíta ) y sulfato de calcio , yeso. [7]
Como la celda de mercurio utilizada en la industria cloro-álcali ( proceso Castner-Kellner ) se está eliminando gradualmente debido a las preocupaciones sobre las emisiones de mercurio, el mercurio metálico de estas instalaciones se convierte en sulfuro de mercurio para almacenamiento subterráneo.
Con un ancho de banda de 2,1 eV y su estabilidad, es posible utilizarlo como celda fotoelectroquímica . [8]