Un oogonio ( pl.: oogonia ) es una pequeña célula diploide que, al madurar, forma un folículo primordial en un feto femenino o el gametangio femenino (haploide o diploide) de ciertas talofitas .
Las ovogonias se forman en gran número por mitosis en las primeras etapas del desarrollo fetal a partir de células germinales primordiales . En los seres humanos, comienzan a desarrollarse entre las semanas 4 y 8 y están presentes en el feto entre las semanas 5 y 30.
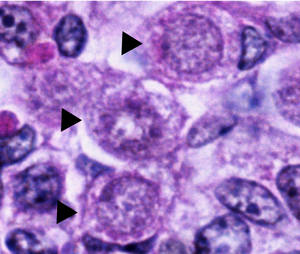
Las ovogonias normales en los ovarios humanos tienen forma esférica u ovoide y se encuentran entre las células somáticas vecinas y los ovocitos en diferentes fases de desarrollo. Las ovogonias se pueden distinguir de las células somáticas vecinas, bajo un microscopio electrónico , observando sus núcleos . Los núcleos oogoniales contienen material fibrilar y granular disperso aleatoriamente, mientras que las células somáticas tienen un núcleo más condensado que crea un contorno más oscuro bajo el microscopio. Los núcleos oogoniales también contienen nucléolos densos y prominentes . El material cromosómico en el núcleo de las ovogonias en división mitótica se muestra como una masa densa rodeada de vesículas o membranas dobles. [1]
El citoplasma de las ovogonias es similar al de las células somáticas circundantes y también contiene mitocondrias grandes y redondas con crestas laterales . Sin embargo, el retículo endoplasmático (RE) de las ovogonias está muy poco desarrollado y está formado por varias vesículas pequeñas. Algunas de estas vesículas pequeñas contienen cisternas con ribosomas y se encuentran ubicadas cerca del aparato de Golgi . [1]
Las ovogonias que están degenerando se ven ligeramente diferentes bajo el microscopio electrónico. En estas ovogonias, los cromosomas se agrupan en una masa indistinguible dentro del núcleo y las mitocondrias y el RE parecen estar hinchados y desorganizados. Las ovogonias en degeneración suelen encontrarse parcial o totalmente envueltas en células somáticas vecinas, lo que identifica la fagocitosis como el modo de eliminación. [1]
En el blastocisto del embrión de mamífero , las células germinales primordiales surgen de los epiblastos proximales bajo la influencia de señales extraembrionarias. Estas células germinales luego viajan, a través del movimiento ameboides, a la cresta genital y finalmente a las gónadas indiferenciadas del feto. [2] Durante la cuarta o quinta semana de desarrollo, las gónadas comienzan a diferenciarse. En ausencia del cromosoma Y, las gónadas se diferenciarán en ovarios. A medida que los ovarios se diferencian, se desarrollan crecimientos internos llamados cordones corticales. Aquí es donde se acumulan las células germinales primordiales. [3] [4]
Durante la sexta a la octava semana del desarrollo embrionario femenino (XX), las células germinales primordiales crecen y comienzan a diferenciarse en ovogonias. Las ovogonias proliferan por mitosis durante la novena a la vigésimo segunda semana del desarrollo embrionario. Puede haber hasta 600.000 ovogonias en la octava semana de desarrollo y hasta 7.000.000 en el quinto mes. [3]
Finalmente, las ovogonias se degenerarán o se diferenciarán aún más en ovocitos primarios a través de una división asimétrica. La división asimétrica es un proceso de mitosis en el que una ovogonia se divide de manera desigual para producir una célula hija que eventualmente se convertirá en un ovocito a través del proceso de ovogénesis , y una célula hija que es una ovogonia idéntica a la célula madre. Esto ocurre durante la semana 15 al mes 7 del desarrollo embrionario. [2] La mayoría de las ovogonias se han degenerado o diferenciado en ovocitos primarios al nacer. [3] [5]
Los ovocitos primarios experimentan ovogénesis, en la que entran en meiosis . Sin embargo, los ovocitos primarios se detienen en la profase 1 de la primera meiosis y permanecen en esa etapa de detención hasta que comienza la pubertad en la mujer adulta. [6] Esto contrasta con las células germinales primordiales masculinas, que se detienen en la etapa de espermatogonias al nacer y no entran en la espermatogénesis y la meiosis para producir espermatocitos primarios hasta la pubertad en el hombre adulto. [3]
La regulación y diferenciación de las células germinales en gametocitos primarios depende en última instancia del sexo del embrión y de la diferenciación de las gónadas. En ratones hembra, la proteína RSPO1 es responsable de la diferenciación de las gónadas femeninas (XX) en ovarios . RSPO1 activa la vía de señalización de la β-catenina regulando positivamente Wnt4 , que es un paso esencial en la diferenciación ovárica. Las investigaciones han demostrado que los ovarios que carecen de Rspo1 o Wnt4 exhibirán inversión sexual de las gónadas, la formación de ovotestículos y la diferenciación de células de Sertoli somáticas , que ayudan en el desarrollo de los espermatozoides . [4]
Después de que las células germinales femeninas (XX) se acumulan en las gónadas indiferenciadas, la regulación positiva de Stra8 es necesaria para la diferenciación de las células germinales en un oogonio y, finalmente, entrar en la meiosis. Un factor importante que contribuye a la regulación positiva de Stra8 es el inicio de la vía de señalización de β-catenina a través de RSPO1, que también es responsable de la diferenciación ovárica. Dado que RSPO1 se produce en células somáticas, esta proteína actúa sobre las células germinales de un modo paracrino . Sin embargo, Rspo1 no es el único factor en la regulación de Stra8 . Muchos otros factores están bajo escrutinio y este proceso aún se está evaluando. [4]
Se ha planteado la teoría de que las ovogonias se degeneran o se diferencian en ovocitos primarios que entran en ovogénesis y se detienen en la profase I de la primera meiosis posparto. Por lo tanto, se cree que las hembras adultas de mamíferos carecen de una población de células germinales que puedan renovarse o regenerarse, y en su lugar tienen una gran población de ovocitos primarios que se detienen en la primera meiosis hasta la pubertad . [2] En la pubertad, un ovocito primario continuará la meiosis en cada ciclo menstrual . Debido a que hay una ausencia de células germinales regenerativas y ovogonias en el ser humano, la cantidad de ovocitos primarios disminuye después de cada ciclo menstrual hasta la menopausia , cuando la mujer ya no tiene una población de ovocitos primarios. [2]
Sin embargo, investigaciones recientes han identificado que las ovogonias renovables pueden estar presentes en el revestimiento de los ovarios femeninos de humanos, primates y ratones. [2] [7] [8] Se cree que estas células germinales podrían ser necesarias para el mantenimiento de los folículos reproductivos y el desarrollo de los ovocitos, hasta bien entrada la edad adulta. También se ha descubierto que algunas células madre pueden migrar desde la médula ósea a los ovarios como fuente de células germinales extrageniales. Estas células germinales mitóticamente activas que se encuentran en los adultos mamíferos se identificaron mediante el seguimiento de varios marcadores que eran comunes en los ovocitos. Estas posibles células germinales renovables se identificaron como positivas para estos marcadores esenciales de ovocitos. [2]
El descubrimiento de estas células germinales activas y ovogonias en la hembra adulta podría ser muy útil para el avance de la investigación sobre la fertilidad y el tratamiento de la infertilidad. [2] [8] Se han extraído, aislado y cultivado células germinales con éxito in vitro . [8] Estas células germinales se han utilizado para restaurar la fertilidad en ratones al promover la generación y el mantenimiento de folículos en ratones previamente infértiles. También se están realizando investigaciones sobre la posible regeneración de la línea germinal en primates. Las células germinales femeninas humanas mitóticamente activas podrían ser muy beneficiosas para un nuevo método de desarrollo de células madre embrionarias que implica una transferencia nuclear a un cigoto . El uso de estas ovogonias funcionales puede ayudar a crear líneas de células madre específicas del paciente utilizando este método. [2]
Existe una gran controversia sobre la existencia de células madre ovogoniales de mamíferos. La controversia radica en los datos negativos que se han originado en muchos laboratorios de los Estados Unidos. Múltiples enfoques para verificar la existencia de células madre ovogoniales han arrojado resultados negativos, y ningún grupo de investigación en los Estados Unidos ha sido capaz de reproducir los hallazgos iniciales. [9] [10] [11]
.jpg/440px-Oogonium_--_3_(34809275943).jpg)
En ficología y micología , oogonio se refiere a un gametangio femenino si la unión del gameto masculino (móvil o no móvil) y el femenino tiene lugar dentro de esta estructura. [12] [13]
En Oomycota y otros organismos, las oogonias femeninas y los anteridios masculinos equivalentes son el resultado de la esporulación sexual, es decir, el desarrollo de estructuras dentro de las cuales ocurrirá la meiosis. Los núcleos haploides (gametos) se forman por meiosis dentro de los anteridios y las oogonias, y cuando ocurre la fertilización, se produce una oospora diploide que eventualmente germinará en la etapa somática diploide del ciclo de vida del talofito. [14]
En muchas algas (p. ej., Chara ), la planta principal es haploide; se forman oogonias y anteridios y producen gametos haploides. La única parte diploide del ciclo de vida es la espora (óvulo fertilizado), que experimenta meiosis para formar células haploides que se desarrollan en nuevas plantas. Este es un ciclo de vida haplóntico (con meiosis cigótica ).
Las oogonias de ciertas especies de talofitas [ ¿cuáles? ] suelen ser redondas u ovoides, con contenidos divididos en varias oosferas uninucleadas . Esto contrasta con los anteridios masculinos que son alargados y contienen varios núcleos. [14]
En las especies heterotálicas , las oogonias y los anteridios se encuentran en las ramas hifales de diferentes colonias de talofitos. Las oogonias de esta especie solo pueden ser fecundadas por anteridios de otra colonia y garantizan que la autofecundación sea imposible. [ aclaración necesaria ] Por el contrario, las especies homotálicas muestran las oogonias y los anteridios en la misma rama hifal o en ramas hifales separadas pero dentro de la misma colonia. [14]
En un modo común de fertilización que se encuentra en ciertas especies de talofitas, los anteridios se unirán a las oogonias. Los anteridios luego formarán tubos de fertilización que conectarán el citoplasma anteridial con cada oosfera dentro de la oogonia. Un núcleo haploide (gameto) del anteridio luego será transferido a través del tubo de fertilización a la oosfera y se fusionará con el núcleo haploide de la oosfera formando una oospora diploide. La oospora entonces está lista para germinar y desarrollarse en una etapa somática diploide adulta. [14]
Lista de los distintos tipos de células del cuerpo humano adulto