
Un carbocatión es un ion con un átomo de carbono cargado positivamente . Entre los ejemplos más simples se encuentran el metenio CH +
3, metanio CH+
5, iones acilio RCO + y vinilo C
2yo+
3cationes. [2]
Hasta principios de la década de 1970, los carbocationes se llamaban iones carbonio . [3] En la definición actual dada por la IUPAC, un carbocatión es cualquier catión de electrones pares con carga positiva parcial significativa en un átomo de carbono. Se clasifican además en dos categorías principales según el número de coordinación del carbono cargado: tres en los iones de carbenio y cinco en los iones de carbonio . Esta nomenclatura fue propuesta por GA Olah . [4] Los iones de carbonio, como los definió originalmente Olah, se caracterizan por un esquema de enlace deslocalizado de dos electrones y tres centros y son esencialmente sinónimos de los llamados " carbocationes no clásicos ", que son carbocationes que contienen enlaces σ de puente C–C o C–H. Sin embargo, otros han definido de forma más estricta el término "ion carbonio" como alcanos formalmente protonados o alquilados ( CR+
5, donde R es H o alquilo), con exclusión de carbocationes no clásicos como el catión 2-norbornilo . [5]
Según la IUPAC , un carbocatión es cualquier catión que contiene un número par de electrones en el que una parte significativa de la carga positiva reside en un átomo de carbono. [6] Antes de la observación de carbocationes de cinco coordenadas por Olah y colaboradores, carbocatión e ion carbonio se usaban indistintamente. Olah propuso una redefinición del ion carbonio como un carbocatión que presenta cualquier tipo de enlace de dos electrones de tres centros, mientras que un ion carbenio fue acuñado recientemente para referirse a un carbocatión que contiene solo enlaces de dos electrones de dos centros con un carbono positivo de tres coordenadas. Posteriormente, otros han utilizado el término ion carbonio de manera más restringida para referirse a especies que se derivan (al menos formalmente) del ataque electrofílico de H + o R + en un alcano, en analogía con otras especies de onio del grupo principal , mientras que un carbocatión que contiene cualquier tipo de enlace de tres centros se conoce como un carbocatión no clásico . En este uso, el catión 2-norbornilo no es un ion carbonio, porque se deriva formalmente de la protonación de un alqueno (norborneno) en lugar de un alcano, aunque es un carbocatión no clásico debido a su estructura de puente. La IUPAC reconoce las tres definiciones divergentes de ion carbonio e insta a tener cuidado en el uso de este término. En el resto de este artículo, el término ion carbonio se utilizará en este último sentido restringido, mientras que el término carbocatión no clásico se utilizará para referirse a cualquier carbocatión con enlaces σ C–C y/o C–H deslocalizados por puentes.

Los iones carbonio pueden considerarse alcanos protonados o alquilados. Presentan enlaces 3c-2e deslocalizados. Por este motivo, a menudo se los denomina iones no clásicos. Un ejemplo bien estudiado, aunque sin valor práctico, es el catión 2-norbornilo . Al igual que los iones carbenio, los iones carbonio se utilizan a menudo como intermediarios en la mejora de los hidrocarburos en las refinerías.
Al menos en un sentido formal, los iones de carbenio se derivan de la protonación (adición de H + ) o alquilación (adición de R + ) de un carbeno o alqueno . Así, en al menos una de sus representaciones de resonancia , poseen un átomo de carbono con una carga positiva formal que está rodeado por un sexteto de electrones (seis electrones de valencia ) en lugar del octeto habitual requerido para llenar la capa de valencia del carbono ( regla del octeto ). Por lo tanto, los iones de carbenio (y los carbocationes en general) suelen ser reactivos, buscando llenar el octeto de electrones de valencia y recuperar una carga neutra . De acuerdo con la regla de Bent y la RPECV , a menos que esté geométricamente restringido a ser piramidal (por ejemplo, el catión 1-adamantilo), el carbono 3-coordinado en los iones de carbenio suele ser trigonal plano, con un orbital vacío de carácter p puro como su orbital molecular desocupado más bajo (LUMO) y enlaces CH/CC formados a partir de orbitales C(sp 2 ). Un ejemplo prototípico es el catión metilo, CH+3.
La historia de los carbocationes se remonta a 1891 cuando G. Merling [8] informó que agregó bromo al tropilideno ( cicloheptatrieno ) y luego calentó el producto para obtener un material cristalino soluble en agua, C
7yo
7Br . No sugirió una estructura para él; sin embargo, Doering y Knox [9] demostraron de manera convincente que se trataba de bromuro de tropilio (cicloheptatrienilio). Se predice que este ion es aromático según la regla de Hückel .
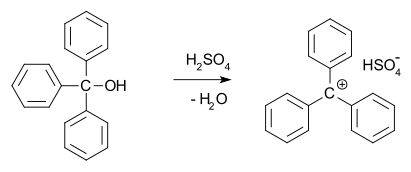
En 1902, Norris y Kehrman descubrieron de forma independiente que el trifenilmetanol incoloro produce soluciones de color amarillo intenso en ácido sulfúrico concentrado . El cloruro de trifenilmetilo formaba complejos de color naranja de forma similar cuando se trataba con cloruros de aluminio y estaño. En 1902, Adolf von Baeyer reconoció el carácter salino de los compuestos formados. Denominó la relación entre el color y la formación de sales halocromía , de la que el verde malaquita es un excelente ejemplo. El carbocatión tritilo (que se muestra a continuación) es de hecho un sistema carbocatiónico estable, por ejemplo en forma de hexafluorofosfato de tritilo . [10]
Los carbocationes son intermediarios reactivos en muchas reacciones orgánicas. Esta idea, propuesta por primera vez por Julius Stieglitz en 1899, [11] fue desarrollada por Hans Meerwein en su estudio de 1922 [12] [13] sobre el reordenamiento de Wagner-Meerwein . También se descubrió que los carbocationes estaban involucrados en la reacción S N 1 , la reacción E1 y en reacciones de reordenamiento como el desplazamiento de Whitmore 1,2 . El establishment químico era reacio a aceptar la noción de un carbocatión y durante mucho tiempo el Journal of the American Chemical Society rechazó artículos que los mencionaran.
Doering et al. [14] informaron por primera vez en 1958 un espectro de RMN de un carbocatión. Se trataba del ion heptametilbenceno , obtenido mediante el tratamiento de hexametilbenceno con cloruro de metilo y cloruro de aluminio . El catión 7-norbornadienilo estable fue preparado por Story et al. en 1960 [15] mediante la reacción de cloruro de norbornadienilo con tetrafluoroborato de plata en dióxido de azufre a -80 °C. El espectro de RMN estableció que no tenía un puente clásico (el primer ion no clásico estable observado).
En 1962, Olah observó directamente el carbocatión de terc -butilo mediante resonancia magnética nuclear como una especie estable al disolver fluoruro de terc -butilo en ácido mágico . El espectro de RMN del catión norbornilo fue informado por Schleyer et al. [16] Se demostró que experimenta rápidamente una aleatorización de protones. [17]