Los compuestos de rutenio son compuestos que contienen el elemento rutenio (Ru). Los compuestos de rutenio pueden tener estados de oxidación que van desde 0 a +8 y -2. Las propiedades de los compuestos de rutenio y osmio suelen ser similares. Los estados +2, +3 y +4 son los más comunes. El precursor más frecuente es el tricloruro de rutenio , un sólido rojo poco definido químicamente pero versátil sintéticamente. [1]
El rutenio se puede oxidar a óxido de rutenio (IV) (RuO 2 , estado de oxidación +4), que, a su vez, puede ser oxidado por metaperyodato de sodio al tetróxido de rutenio tetraédrico amarillo volátil , RuO 4 , un agente oxidante fuerte y agresivo con estructura y propiedades análogas al tetróxido de osmio . El RuO 4 se utiliza principalmente como intermediario en la purificación del rutenio a partir de minerales y desechos radiactivos. [2]
También se conocen el rutenato dipotásico (K 2 RuO 4 , +6) y el perrutenato de potasio (KRuO 4 , +7). [3] A diferencia del tetróxido de osmio, el tetróxido de rutenio es menos estable, es lo suficientemente fuerte como agente oxidante para oxidar ácido clorhídrico diluido y solventes orgánicos como el etanol a temperatura ambiente, y se reduce fácilmente a rutenato ( RuO2−
4) en soluciones alcalinas acuosas; se descompone para formar dióxido por encima de los 100 °C. A diferencia del hierro pero como el osmio, el rutenio no forma óxidos en sus estados de oxidación inferiores +2 y +3. [4] El rutenio forma dicalcogenuros , que son semiconductores diamagnéticos que cristalizan en la estructura de la pirita . [4] El sulfuro de rutenio (RuS 2 ) se presenta de forma natural como el mineral laurita .
Al igual que el hierro, el rutenio no forma fácilmente oxoaniones y prefiere alcanzar altos números de coordinación con iones hidróxido. El tetróxido de rutenio se reduce con hidróxido de potasio diluido en frío para formar perrutenato de potasio negro, KRuO 4 , con rutenio en el estado de oxidación +7. El perrutenato de potasio también se puede producir oxidando rutenato de potasio, K 2 RuO 4 , con gas cloro. El ion perrutenato es inestable y se reduce con agua para formar el rutenato de color naranja. El rutenato de potasio se puede sintetizar haciendo reaccionar el metal rutenio con hidróxido de potasio fundido y nitrato de potasio . [5]
También se conocen algunos óxidos mixtos, como M II Ru IV O 3 , Na 3 Ru V O 4 , Na
2RuVersión
2Oh
7, y M2.2
EnIII
RuV
Oh
6. [5]

El haluro de rutenio más conocido es el hexafluoruro , un sólido marrón oscuro que se funde a 54 °C. Se hidroliza violentamente al entrar en contacto con el agua y se desproporciona fácilmente para formar una mezcla de fluoruros de rutenio inferiores, liberando gas flúor. El pentafluoruro de rutenio es un sólido tetramérico de color verde oscuro que también se hidroliza fácilmente y se funde a 86,5 °C. El tetrafluoruro de rutenio amarillo probablemente también sea polimérico y se pueda formar reduciendo el pentafluoruro con yodo . Entre los compuestos binarios del rutenio, estos altos estados de oxidación se conocen solo en los óxidos y fluoruros. [6]
El tricloruro de rutenio es un compuesto bien conocido, que existe en una forma α negra y una forma β marrón oscura: el trihidrato es rojo. [7] De los trihaluros conocidos, el trifluoruro es marrón oscuro y se descompone por encima de los 650 °C, el tribromuro es marrón oscuro y se descompone por encima de los 400 °C, y el triyoduro es negro. [6] De los dihaluros, el difluoruro no se conoce, el dicloruro es marrón, el dibromuro es negro y el diyoduro es azul. [6] El único oxihaluro conocido es el oxifluoruro de rutenio(VI) verde pálido, RuOF 4 . [7]
ruthenium(II)-chloride-powder.jpg/440px-Tris(bipyridine)ruthenium(II)-chloride-powder.jpg)
El rutenio forma una variedad de complejos de coordinación. Algunos ejemplos son los numerosos derivados de pentaamina [Ru(NH 3 ) 5 L] n+ que a menudo existen tanto para Ru(II) como para Ru(III). Los derivados de bipiridina y terpiridina son numerosos, siendo el más conocido el cloruro de tris(bipiridina)rutenio(II) luminiscente .
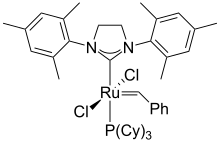
El rutenio forma una amplia gama de compuestos con enlaces carbono-rutenio. El catalizador de Grubbs se utiliza para la metátesis de alquenos. [8] El rutenioceno es análogo al ferroceno estructuralmente, pero exhibe propiedades redox distintivas. El pentacarbonilo de rutenio líquido incoloro se convierte en ausencia de presión de CO en el dodecacarbonilo de trirutenio sólido rojo oscuro . El tricloruro de rutenio reacciona con monóxido de carbono para dar muchos derivados, incluidos RuHCl(CO)(PPh 3 ) 3 y Ru(CO) 2 (PPh 3 ) 3 ( complejo de Roper ). Calentando soluciones de tricloruro de rutenio en alcoholes con trifenilfosfina se obtiene dicloruro de tris(trifenilfosfina)rutenio (RuCl 2 (PPh 3 ) 3 ), que se convierte en el complejo hidruro clorhidridotris(trifenilfosfina)rutenio(II) (RuHCl(PPh 3 ) 3 ). [1]