
En química , un óxido de amina , también conocido como N -óxido de amina o simplemente N -óxido , es un compuesto químico que tiene la fórmula química R 3 N + −O − . Contiene un enlace covalente coordinado entre nitrógeno y oxígeno con tres grupos adicionales de hidrógeno y/o sustituyentes unidos al nitrógeno. A veces se escribe como R 3 N→O o, alternativamente, [1] como R 3 N=O .
En sentido estricto, el término óxido de amina se aplica únicamente a los óxidos de aminas terciarias . A veces también se utiliza para derivados análogos de aminas primarias y secundarias.
Ejemplos de óxidos de amina incluyen N -óxido de piridina , un sólido cristalino soluble en agua con un punto de fusión de 62 a 67 °C, y N -óxido de N -metilmorfolina , que es un oxidante.
Los óxidos de amina son tensioactivos comúnmente utilizados en productos de consumo como champús, acondicionadores, detergentes y limpiadores de superficies duras. [2] El óxido de alquildimetilamina (longitudes de cadena C10-C16) es el óxido de amina más utilizado comercialmente. [3] Se consideran una clase de compuestos de alto volumen de producción en más de un país miembro de la Organización para la Cooperación y el Desarrollo Económico ( OCDE ); con una producción anual de más de 26.000, 16.000 y 6.800 toneladas (28.700, 17.600 y 7.500 toneladas cortas) en Estados Unidos, Europa y Japón, respectivamente. [2] En América del Norte, más del 95% de los óxidos de amina se utilizan en productos de limpieza para el hogar. [4] Sirven como estabilizadores, espesantes, emolientes, emulsionantes y acondicionadores con concentraciones activas en el rango de 0,1 a 10%. [2] El resto (< 5%) se utiliza en productos de cuidado personal, institucionales y comerciales [5] y para usos patentados únicos, como la fotografía. [2]
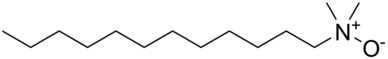
Los óxidos de amina se utilizan como grupo protector de aminas y como intermediarios químicos . Los óxidos de alquilamina de cadena larga se utilizan como tensioactivos anfóteros y estabilizadores de espuma .
Los óxidos de amina son moléculas altamente polares y tienen una polaridad cercana a la de las sales de amonio cuaternario . Los óxidos de amina pequeños son muy hidrófilos y tienen una excelente solubilidad en agua y una solubilidad muy pobre en la mayoría de los disolventes orgánicos .
Los óxidos de amina son bases débiles con un p K b de alrededor de 4,5 que forman R 3 N + −OH , hidroxilaminas catiónicas , tras la protonación a un pH inferior a su p K b .
Casi todos los óxidos de amina se preparan mediante la oxidación de aminas alifáticas terciarias o de N - heterociclos aromáticos . El peróxido de hidrógeno es el reactivo más común tanto a nivel industrial como académico; sin embargo, los perácidos también son importantes. [6] Los agentes oxidantes más especializados pueden tener un uso específico, por ejemplo, el ácido de Caro o m CPBA . Las reacciones espontáneas o catalizadas que utilizan oxígeno molecular son raras. Algunas otras reacciones también producirán óxidos de amina, como la eliminación retro-Cope , sin embargo, rara vez se emplean.
Los óxidos de amina exhiben muchos tipos de reacciones. [7]
Los óxidos de amina son metabolitos comunes de medicamentos y drogas psicoactivas . Los ejemplos incluyen la nicotina , el zolmitriptán y la morfina .
Los óxidos de amina de los fármacos contra el cáncer se han desarrollado como profármacos que se metabolizan en el tejido canceroso deficiente en oxígeno hasta convertirse en el fármaco activo.
No se sabe que los óxidos de amina (AO) sean carcinógenos, sensibilizadores dérmicos o tóxicos para la reproducción. Se metabolizan y excretan fácilmente si se ingieren. La ingestión crónica por parte de conejos encontró un menor peso corporal, diarrea y opacidades lenticulares en los niveles más bajos de efectos adversos observados (LOAEL) en el rango de 87 a 150 mg AO/kw pc/día. Las pruebas de exposición de la piel humana han encontrado que después de 8 horas, el cuerpo absorbe menos del 1%. La irritación ocular debida a los óxidos de amina y otros tensioactivos es moderada y temporal sin efectos duraderos. [2]
Se ha medido que los óxidos de amina con una longitud de cadena promedio de 12,6 son solubles en agua a ~410 g/L. Se considera que tienen un bajo potencial de bioacumulación en especies acuáticas según los datos de log K ow de longitudes de cadena inferiores a C14 (factor de bioconcentración <87%). [2] Se encontró que los niveles de AO en el afluente no tratado eran de 2,3 a 27,8 ug/L, mientras que en el efluente eran de 0,4 a 2,91 ug/L. Las mayores concentraciones de efluentes se encontraron en las plantas de tratamiento de zanjas de oxidación y filtros percoladores. En promedio, se ha encontrado más del 96% de eliminación con el tratamiento secundario de lodos activados. [3] La toxicidad aguda en peces, según lo indicado por las pruebas de LC50 de 96 h, está en el rango de 1000 a 3000 ug/L para longitudes de cadena de carbono inferiores a C14. Los valores de LC50 para longitudes de cadena superiores a C14 oscilan entre 600 y 1400 ug/L. Los datos de toxicidad crónica para peces son 420 ug/L. Cuando se normaliza a C12.9, el NOEC es de 310 ug/L para crecimiento e incubabilidad. [3]