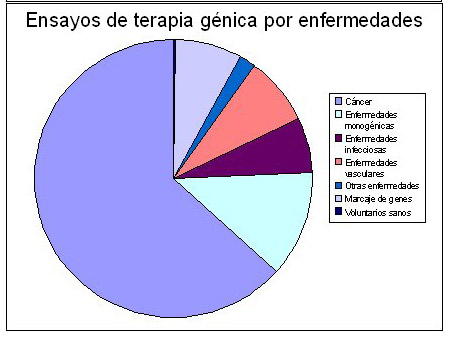
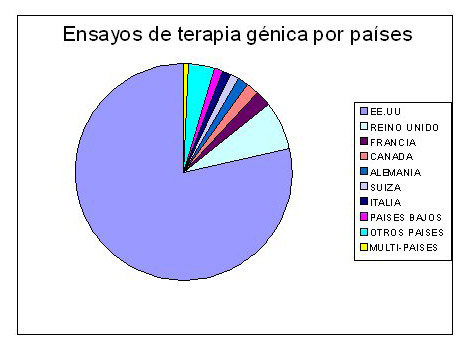
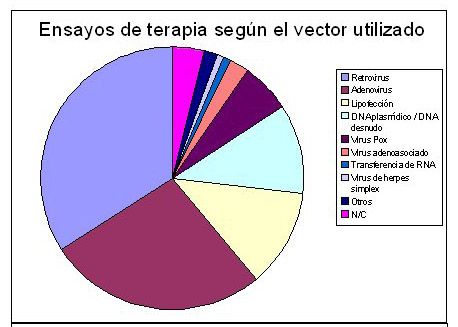
Terapia génica
En este enfoque, un vector que codifica una proteína específica se une a un material biocompatible.
Sin embargo, pueden definirse las siguientes características para un "vector ideal" y adaptarlas luego a situaciones concretas: Los vectores van a contener los elementos que queramos introducir al paciente, que no van a ser solo los genes funcionales, sino también elementos necesarios para su expresión y regulación, como pueden ser promotores, potenciadores o secuencias específicas que permitan su control bajo ciertas condiciones.
Cuando un retrovirus infecta a una célula huésped, introduce su ARN junto con algunas enzimas que se encuentran en la matriz, concretamente una proteasa, una transcriptasa inversa y una integrasa.
[cita requerida] Los retrovirus como vector en terapia génica presentan un inconveniente considerable, y es que la enzima integrasa puede insertar el material genético en cualquier zona del genoma del huésped, pudiendo causar efectos deletéreos como la modificación en el patrón de la expresión (efecto posicional) o la mutagénesis de un gen silvestre por inserción.
[cita requerida] En la actualidad, la terapia génica para tratar SCID continúa siendo exitosa en Estados Unidos, Gran Bretaña, Italia y Japón.
En su lugar, el genoma vírico recombinante fusiona sus extremos a través del ITR (repeticiones terminales invertidas), apareciendo recombinación de la forma circular y episomal que se predice que pueden ser la causa de la expresión génica a largo plazo.
[cita requerida] Esto es posible porque VAA pueden infectar células que no están en estado de división, tales como las neuronas.
Estas proteínas interaccionan con receptores celulares que pueden inducir cambios estructurales en el virus y contribuir a su entrada en la célula por endocitosis.
Este avance podría permitir la administración sistemática de una cantidad relativamente pequeña del vector.
El vector de ADN puede ser cubierto por lípidos formando una estructura organizada, como una micela o un liposoma.
Sin embargo, estos son relativamente tóxicos, incompatibles con fluidos corporales y presentan la posibilidad de adaptarse a permanecer en un tejido específico.
Además, son complejos y requieren tiempo para producirlos, por lo que la atención se dirigió a las versiones catiónicas.
Sin embargo, si los genes no pueden liberarse al citoplasma por rotura de la membrana del endosoma, los liposomas y el ADN contenido serán destruidos.
El uso de ciertos compuestos químicos, como la cloroquina, permite al ADN exógeno escapar del lisosoma, si bien deben usarse con precaución, ya que es tóxico y debe usarse en dosis pequeñas para no afectar a la célula diana de transfección.
Realizó la transformación ex-vivo con los linfocitos T del paciente, que luego se volvieron a introducir en su cuerpo.
No obstante, el apoyo a la terapia fue cuestionado cuando algunos niños tratados para SCID desarrollaron leucemia.
En el año 2002, cuatro ensayos en marcha de terapia génica se paralizaron al desarrollarse en un niño tratado una enfermedad similar a la leucemia.
[14] La transferencia de genes en este órgano es un logro significativo porque los vectores virales son demasiado grandes para cruzar la barrera hematoencefálica.
Este estudio constituye la primera demostración de que la terapia génica puede ser efectivamente un tratamiento contra el cáncer.
El estudio,[17] publicado en Nature Medicine, es pionero en mostrar que la terapia génica puede curar enfermedades del sistema mieloide.
La Amaurosis congénita de Leber es una enfermedad hereditaria que causa la ceguera por mutaciones en el gen RPE65.
Los pacientes mostraron incremento de la visión, y no se presentaron efectos secundarios aparentes.
[30] En estos pacientes no se ha podido retirar el tratamiento enzimático exógeno necesario para su supervivencia, sino solo disminuirlo a la mitad y se ha detectado la persistencia en la expresión del gen aun después de cuatro años de iniciado el protocolo.
Aunque no se haya logrado la completa curación de los pacientes (que consistiría en retirar todo el aporte enzimático exógeno) este constituye un hecho inédito en la historia terapéutica.
En 2009 se hace un nuevo experimento en el que extraen células hematopoyéticas de la médula ósea para la introducción del gen ADA ex vivo mediante un retrovirus modificado (GIADA).
Los principales métodos que utiliza la terapia génica en el cáncer son: El síndrome de Wiskott-Aldrich (WAS) es una enfermedad recesiva ligada al cromosoma X caracterizada por eczema, trombocitopenia, infecciones recurrentes, inmunodeficiencia así como una gran tendencia a los linfomas y a las enfermedades autoinmunes.
La mayoría de los que padecen este síndrome sufren una muerte prematura debido a una infección, hemorragia, cáncer o anemia grave autoinmune.
Para llevarlo a cabo se pretende emplear lentivirus porque varios estudios muestran la corrección de la β-talasemia en modelos animales.
Este tipo de aspectos a tener en cuenta se recogen en la Declaración Universal sobre el Genoma Humano.
Se ha dado este caso en los ensayos clínicos para SCID ligada al cromosoma X, en los cuales 3 de 20 pacientes desarrollaron leucemia.

![[9]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/39/Tabla_comparativa_virus.png/669px-Tabla_comparativa_virus.png)