Proceso isotérmico
Se denomina proceso isotérmico o proceso isotermo al cambio reversible en un sistema termodinámico, siendo en dicho cambio la temperatura constante en todo el sistema.
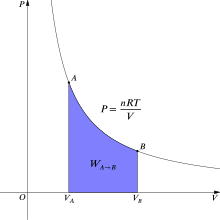
Como la energía interna de un gas ideal solo depende de la temperatura y ésta permanece constante en la expansión isoterma, el calor tomado del foco es igual al trabajo realizado por el gas: Q = W. Una curva isoterma es una línea que sobre un diagrama representa los valores sucesivos de las diversas variables de un sistema en un proceso isotermo.
Las isotermas de un gas ideal en un diagrama P-V, llamado diagrama de Clapeyron, son hipérbolas equiláteras, cuya ecuación es P•V = constante.
se puede escribir como dx, entonces: Pero Adx equivale a dV, el aumento en el volumen del gas durante esta pequeña expansión, entonces el trabajo efectuado por el gas sobre los alrededores como resultado de la expansión es: Ahora reemplazando (1) en (2) se puede integrar: Pero para integrar la tercera integral, es necesario conocer la forma de variación de la presión P con el volumen, durante el proceso tratado.
En el caso de tratar con gases ideales, se tendría la relación: Por lo tanto reemplazando (4) en (3) se tiene que: Como los valores n y R son constantes para cada gas ideal, y en este caso la temperatura también es constante, éstas pueden salir fuera de la integral obteniéndose: Ahora integrando: Pero se sabe que la energía interna depende solo de la temperatura (Ver: La energía interna como función de la temperatura), y como en este proceso ésta se mantiene constante, no hay cambio en la energía interna del gas, por lo que la expresión (5) se reduce a: Por lo tanto, en una expansión isotérmica de un gas perfecto, el calor de entrada es igual al trabajo efectuado por el gas.